
【题目】电解合成 1 , 2-二氯乙烷的实验装置如图所示。下列说法中正确的是
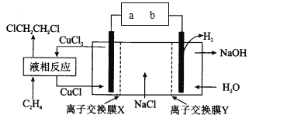
A.a为电源的负极
B.CuCl2能将C2H4还原为 l , 2-二氯乙烷
C.X、Y依次为阳离子交换膜、阴离子交换膜
D.该装置总反应为CH2=CH2+ 2H2O + 2NaCl![]() H2+ 2NaOH + ClCH2CH2Cl
H2+ 2NaOH + ClCH2CH2Cl
【答案】D
【解析】
据图可知装置左侧CuCl转化为CuCl2,铜元素被氧化,所以左侧为电解池的阳极,则a为电源正极;右侧为电解池阴极,则b为电源负极。
A.根据分析可知,a为电源的正极,故A错误;
B.据图可知,液相反应中发生的反应为C2H4+2CuCl2=ClCH2CH2Cl+2CuCl,该反应中CuCl2中铜元素化合价降低,C2H4中C元素化合价升高,即CuCl2将C2H4氧化成为ClCH2CH2Cl,故B错误;
C.阴极H2O或H+放电生成NaOH,则中间室中钠离子要进入阴极区,所以离子交换膜Y为阳离子交换膜;阳极CuCl放电转化为CuCl2,氯离子要进入阳极区,所以离子交换膜X为阴离子交换膜,故C错误;
D.以NaCl和CH2=CH2为原料合成1,2二氯乙烷中,CuCl→CuCl2→CuCl,CuCl循环使用,其实质是NaCl、H2O与CH2=CH2反应,所以总反应为CH2=CH2+2H2O+2NaCl![]() H2↑+2NaOH+ClCH2CH2Cl,故D正确;
H2↑+2NaOH+ClCH2CH2Cl,故D正确;
综上所述答案为D。


科目:高中化学 来源: 题型:
【题目】电镀是应用电解原理在某些金属表面镀上一薄层其它金属或合金的方法。在铁质铆钉上镀镍(Ni)能防止铁被腐蚀,如图1。实验室模拟铁片镀镍,装置如图2。

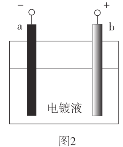
(1)b极材料是__。
(2)电镀液中含有NiSO4、NaCl和硼酸。
已知:NiSO4=Ni2++SO![]() 、Ni2++2H2ONi(OH)2+2H+
、Ni2++2H2ONi(OH)2+2H+
①a极的电极反应式是__。
②硼酸的作用是调节溶液的pH。pH较小时,a极易产生__气体,使镀层疏松多孔。pH较大时,a极会吸附__固体而使镀层含有杂质。
(3)铁质铆钉上镀镍能防止铁被腐蚀是因为镀层使铁与__等物质隔离。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素铬(Cr)在自然界主要以+3价和+6价存在。请回答下列问题:
(1)利用铬铁矿(FeO·Cr2O3)冶炼制取金属铬的工艺流程如图所示:
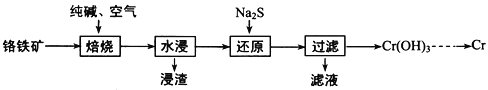
①为加快焙烧速率和提高原料的利用率,可采取的措施之一是_________。
②“水浸”要获得浸出液的操作是________。
(2)常温下,已知Cr3+完全沉淀时溶液pH为5,(Cr3+浓度降至10-5mol·L-1可认为完全沉淀)则Cr(OH)3的溶度积常数Ksp=___。
(3)用石墨电极电解铬酸钠(Na2CrO4)溶液,可制重铬酸钠(Na2Cr2O7),实验装置如图所示(已知:2![]() +2H+2
+2H+2![]() +2H2O)
+2H2O)
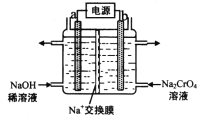
①电极b连接电源的______极(填“正”或“负),b极发生的电极反应:________
②电解一段时间后,测得阳极区溶液中Na+物质的量由amol变为bmol,则理论上生成重铬酸钠的物质的量是________mol(用含a、b的代数式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质结构与性质下表为元素周期表的一部分。请回答下列问题:
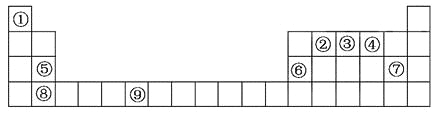
(1)上述元素中,属于s区的是_________(填元素符号)。
(2)写出元素⑨的基态原子的价电子排布图_______。
(3)元素的第一电离能:③______④(选填“大于”或“小于”)。
(4)元素③气态氢化物的VSEPR模型为____;该分子为___分子(选填“极性”或“非极性”)。向硫酸铜溶液中逐滴加入其水溶液,可观察到的现象为_____________。
(5)元素⑥的单质的晶体中原子的堆积方式如图甲所示,其晶胞特征如图乙所示,原子之间相互位置关系的平面图如图丙所示。
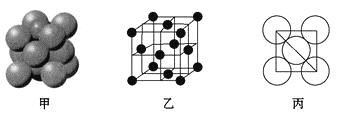
若已知⑥的原子半径为dcm,NA代表阿伏加德罗常数,元素⑥的相对原子质量为M,请回答:晶胞中⑥原子的配位数为____________,该晶体的密度为___________(用字母表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是
A. 已知HI(g) ![]() 1/2H2(g)+1/2I2(s) ΔH=-26.5 kJ·mol-1,由此可知1 mol HI气体在密闭容器中充分分解后可以放出26.5 kJ的热量
1/2H2(g)+1/2I2(s) ΔH=-26.5 kJ·mol-1,由此可知1 mol HI气体在密闭容器中充分分解后可以放出26.5 kJ的热量
B. 已知2H2(g)+O2(g)===2H2O(g) ΔH=-571.6 kJ·mol-1,则氢气的燃烧热为ΔH=-285.8 kJ·mol-1
C. 已知2C(s)+2O2(g)=2CO2(g) ΔH1, 2C(s)+O2(g)=2CO(g) ΔH2,则ΔH1<ΔH2
D. 含20.0 g NaOH的稀溶液与稀盐酸完全中和,放出28.7 kJ的热量,则稀醋酸和稀NaOH溶液反应的热化学方程式为:NaOH(aq)+CH3COOH(aq)===CH3COONa(aq)+H2O(l) ΔH=-57.4 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年8月13日中国科学家合成了首例缺陷诱导的晶态无机硼酸盐单一组分白光材料Ba2 [Sn(OH)6][B(OH)4] 2并获得了该化合物的LED器件,该研究结果有望为白光发射的设计和应用提供一个新的有效策略。
(1)基态Sn原子价层电子的空间运动状态有___种,基态氧原子的价层电子排布式不能表示为![]() ,因为这违背了____原理(规则)。
,因为这违背了____原理(规则)。
(2)[B(OH)4] -中氧原子的杂化轨道类型为____,[B(OH)4] -的空间构型为______。 [Sn(OH)6] 2-中,Sn与O之间的化学键不可能是___。
a ![]() 键 b σ键 c 配位键 d 极性键
键 b σ键 c 配位键 d 极性键
(3)碳酸钡、碳酸镁分解得到的金属氧化物中,熔点较低的是_____(填化学式),其原因是___________。
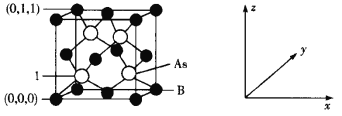
(4)超高热导率半导体材料——砷化硼(BAs)的晶胞结构如下图所示,则1号砷原子的坐标为____。已知阿伏加德罗常数的值为NA,若晶胞中As原子到B原子最近距离为a pm,则该晶体的密度为__g·cm-3(列出含a、NA的计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含氟的卤素互化物通常作氟化剂,使金属氧化物转化为氟化物,如2Co3O4+6ClF3=6CoF3+3Cl2+4X。下列有关该反应的说法,正确的是( )
A.X与O3互为同位素
B.1 mol Co3O4在反应中转移9 mol电子
C.ClF3中氯元素为-3价
D.Co3O4在反应中作氧化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CuCl是应用广泛的有机合成催化剂,可从黄铜矿(主要成分为CuFeS2)中制取。
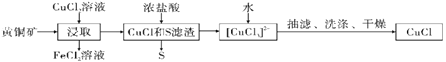
已知:CuCl是一种白色粉末,微溶于水,难溶于乙醇,在空气中易被氧化,在水溶液中存在平衡:CuCl(s)+2Cl-(aq)![]() [CuCl3]2-(aq)(无色溶液),下列叙述错误的是( )
[CuCl3]2-(aq)(无色溶液),下列叙述错误的是( )
A.浸取阶段,参加反应的CuFeS2和CuCl2的物质的量之比为3:l
B.浸取所得到的FeCl2溶液,可用来腐蚀覆在绝缘板上的铜箔制造印刷电路板
C.加水有利于CuCl(s)+2Cl-(aq)![]() [CuCl3]2-(aq)平衡逆向移动,析出CuCl
[CuCl3]2-(aq)平衡逆向移动,析出CuCl
D.为提高产率和纯度,可采用乙醇洗涤、真空干燥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】T°C时,在某恒容的密闭容器中,发生如下反应:SO2(g) +2CO(g) ![]() 2CO2 (g)+ S(l)△H < 0;下列情况不能说明该反应达到平衡状态的是
2CO2 (g)+ S(l)△H < 0;下列情况不能说明该反应达到平衡状态的是
A.容器内混合气体的密度不变
B.容器内压强不变
C.v(CO)生成= v(CO2)消耗
D.S的质量不再改变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com