
| A. | 离子半径:N3->F->Na+ | |
| B. | 上述反应除①外都是氧化还原反应 | |
| C. | 反应②③中的水做氧化剂,每生成1mol H2,转移的电子数为2NA | |
| D. | 反④中的水是还原剂 |
分析 A.电子层越多,半径越大,电子层一样,核电荷数越多,半径越小;
B.有元素化合价变化的反应是氧化还原反应;
C.②NaH+H2O=NaOH+H2↑,H2O中H化合价降低;③2Na+2H2O=2NaOH+H2↑,H2O中H化合价降低;
D.④2F2+2H2O=4HF+O2,H2O中O化合价升高.
解答 解:A.电子层一样,核电荷数越多,半径越小,所以N3->F->Na+,故A正确;
B.①Na3N+H2O=NaOH+NH3 该反应中没有元素化合价发生变化,不属于氧化还原反应,其余都有化合价变化,属于氧化还原反应,故B正确;
C.②NaH+H2O=NaOH+H2↑,H2O中H化合价降低为氧化剂,转移电子数为1e-,则每生成1mol H2,转移的电子数为1NA,③2Na+2H2O=2NaOH+H2↑,H2O中H化合价降低为氧化剂,转移电子数为2e-,则每生成1mol H2,转移的电子数为2NA,故C错误;
D.④2F2+2H2O=4HF+O2,H2O中O化合价升高,所以水是还原剂,故D正确;
故选:C.
点评 本题考查了钠及其化合物的性质,涉及离子半径大小比较、氧化还原反应的判断以及电子转移的计算等,题目难度不大,把握氧化还原反应的规律,准确判断元素的化合价是解题关键.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
| 滴定次数 | 待测溶液的体积/mL | 标准溶液的体积 | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 25.00 | 1.02 | 21.05 |
| 2 | 25.00 | 2.00 | 22.01 |
| 3 | 25.00 | 0.50 | 21.50 |
| 4 | 25.00 | 0.20 | 20.22 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
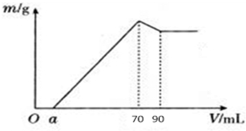
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A+3B═C | B. | 2A+B═C | C. | A+3B═2C | D. | A+3B═3C |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 根据氧化物的性质可将氧化物分成酸性氧化物、碱性氧化物、两性氧化物和特殊氧化物等 | |
| B. | 根据反应中是否有电子转移将化学反应分为氧化还原反应和非氧化还原反应 | |
| C. | 根据分散质粒子直径大小可将液体分散系分为溶液、胶体和浊液 | |
| D. | 根据电解质的水溶液导电能力的强弱将电解质分为强电解质和弱电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | MnO2与浓盐酸反应制Cl2:MnO2+4HCl$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++2Cl-+Cl2↑+2H2O | |
| B. | 碳酸钙与醋酸溶液反应:CaCO3+2H+=Ca2++H2O+CO2↑ | |
| C. | 200mL2mol/L的FeBr2溶液中通入11.2L标准状况下的氯气:4Fe2++6Br-+5Cl2═4Fe3++3Br2+10Cl- | |
| D. | Na2S的水解:S2-+2H2O?H2S+2OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
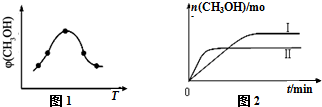
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com