
 常温下,向 100mL0.01mol•L-1HA 溶液中逐滴加入0.02mol•L-1MOH 溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计).下列叙述一定正确的是( )
常温下,向 100mL0.01mol•L-1HA 溶液中逐滴加入0.02mol•L-1MOH 溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计).下列叙述一定正确的是( )| A. | 由图中信息可知HA为弱酸 | |
| B. | 在N点pH=7,酸碱恰好完全反应 | |
| C. | 常温时一定浓度的MA稀溶液显中性 | |
| D. | K 点对应的溶液中,c(M+)+c(MOH)=2c (A-) |
分析 A.由图可知,0.01mol•L-1HA 溶液,其pH=2,可知HA完全电离;
B.N点pH=7,为中性,MOH的体积为51mL,MOH过量1mL;
C.由图中N点可知,MA、MOH的混合溶液显中性,MA为强酸弱碱盐;
D.K点时,MOH为100mL,n(MOH)=2n(HA),结合物料守恒分析.
解答 解:A.由图可知,0.01mol•L-1HA 溶液,其pH=2,可知HA完全电离,则HA为强酸,故A错误;
B.N点pH=7,为中性,MOH的体积为51mL,MOH过量1mL,可知pH<7时酸碱恰好完全反应,故B错误;
C.由N点可知,MA、MOH的混合溶液显中性,MA为强酸弱碱盐,MA稀溶液显酸性,故C错误;
D.K点时,MOH为100mL,n(MOH)=2n(HA),由物料守恒可知,c(M+)+c(MOH)=2c (A-),故D正确;
故选D.
点评 本题考查酸碱混合,为高频考点,把握酸碱的强弱、混合后溶液中的溶质、溶液的酸碱性为解答的关键,侧重分析与应用能力的考查,注意物质的量的相关计算、物料守恒的应用,题目难度不大.


科目:高中化学 来源: 题型:选择题
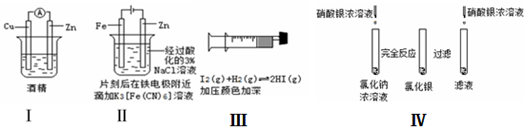
| A. | 方案Ⅰ验证金属活泼性:Zn>Cu | |
| B. | 方案Ⅱ验证Fe电极被保护 | |
| C. | 方案Ⅲ验证平衡移动原理 | |
| D. | 方案Ⅳ验证氯化银在水中存在溶解平衡 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (g)?
(g)? (g)+H2 △H=+124KJ•mol-1
(g)+H2 △H=+124KJ•mol-1| 化学键 | C-H | C-C | C=C | H-H |
| 键能/KJ/mol | 412 | 348 | X | 436 |
 (g)+Cl2(g)?
(g)+Cl2(g)? (g)+HCl(G)△H2>0
(g)+HCl(G)△H2>0
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 A、B、C、D、E、R为原子序数依次增大的六种元素,位于元素周期表的前四周期.B元素原子含有3个能级,且每个能级所含的电子数相同;D的原子核外有8种运动状态不同的电子;E元素与F元素处于同一周期相邻的族,它们的原子序数相差3,且E元素的基态原子3d轨道上有4个未成对电子.请回答下列问题:
A、B、C、D、E、R为原子序数依次增大的六种元素,位于元素周期表的前四周期.B元素原子含有3个能级,且每个能级所含的电子数相同;D的原子核外有8种运动状态不同的电子;E元素与F元素处于同一周期相邻的族,它们的原子序数相差3,且E元素的基态原子3d轨道上有4个未成对电子.请回答下列问题: ,F基态原子的外围电子排布式3d104s1.
,F基态原子的外围电子排布式3d104s1.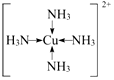 (用元素符号表示).
(用元素符号表示).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用分液漏斗分离硬脂酸钠与甘油的混合物 | |
| B. | 容量瓶用蒸馏水洗涤后须烘干才能使用 | |
| C. | 分馏石油时,温度计的水银球必须插入液面以下 | |
| D. | 氯化钠溶液蒸发结晶时,蒸发皿中有大量晶体析出并剩余少量溶液时应停止加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  可用于吸收NH3或HCl,并防止倒吸 | |
| B. | 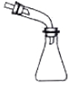 蒸馏时的接收装置 | |
| C. |  除去SO2中的少量HCl | |
| D. |  准确量取一定体积K2Cr2O7标准溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com