

| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 3 |
| 4 |
| C(SO 3)C(NO) |
| c(NO 2)C(SO 2) |
| x 2 |
| (2a-x)(a-x) |
| ||||
|


 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案科目:高中化学 来源: 题型:
| 物质 | MgCl2 | Mg(OH)2 | MgCO3 |
| 溶解度(g) | 74 | 0.0009 | 0.02 |
| A、已知MgCO3的Ksp=6.8×10-6(mol?L-1)2,则所有含固体MgCO3的溶液中,都有c(Mg2+)=c(CO32-),且c(Mg2+)?c(CO32-)=6.8×10-6 (mol?L-1)2 |
| B、将MgCl2与水混合,再对溶液蒸干、灼烧,最终所得固体产物为MgO |
| C、除去粗盐中含有的MgCl2杂质,最佳除杂试剂为Na2CO3溶液 |
| D、用石灰水处理含有Mg2+和HCO3-的硬水,发生的离子反应方程式为:Mg2++2HCO3-+Ca2++2OH-═CaCO3↓+MgCO3↓+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
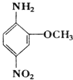 织物的染色,也用于制一些有机颜料,若分子式与红色基B相同,且氨基(-NH2)与硝基(-NO2)直接连在苯环上并呈对位时的同分异构体数目(包括红色基B)为( )
织物的染色,也用于制一些有机颜料,若分子式与红色基B相同,且氨基(-NH2)与硝基(-NO2)直接连在苯环上并呈对位时的同分异构体数目(包括红色基B)为( )| A、2种 | B、4种 | C、6种 | D、10种 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Ⅰ、Ⅱ途径分别达到平衡时,两体系内相同气体的浓度相等 |
| B、Ⅰ、Ⅱ途径分别达到平衡时,两体系内相同气体的体积分数相等 |
| C、Ⅰ、Ⅱ途径分别达到平衡时,两体系内相同气体的反应速率相等 |
| D、Ⅰ、Ⅱ途径分别达到平衡时,Ⅱ的气体密度是Ⅰ的两倍 |
查看答案和解析>>
科目:高中化学 来源: 题型:
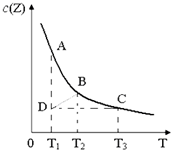 已知在一密闭容器中存在如下化学平衡:X(g)+3Y(g)?2Z(g),其中c(Z)与温度(T)的关系如图所示(曲线上任何一点都表示平衡状态).下列说法中正确的是( )
已知在一密闭容器中存在如下化学平衡:X(g)+3Y(g)?2Z(g),其中c(Z)与温度(T)的关系如图所示(曲线上任何一点都表示平衡状态).下列说法中正确的是( )| A、B点对应的反应速率大于C点对应的反应速率 |
| B、状态A的c(Y)大于状态D c(Y) |
| C、反应X(g)+3Y(g)?2Z(g)的△H<0 |
| D、其他条件不变,缩小容器的体积,平衡可由D点移动到B点 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、水玻璃是制造太阳能电池的常用材料 |
| B、雕花玻璃可以利用氢氟酸对玻璃进行刻蚀而制成 |
| C、常温下可用铁、铝制容器来盛装浓硝酸或浓硫酸 |
| D、氯气可用于自来水厂的杀菌、消毒 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| A、有BaSO4生成 |
| B、有BaSO3生成 |
| C、同时有BaSO4和BaSO3生成 |
| D、无明显现象发生 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| A、-488.3kJ.mol-1 |
| B、-244.15kJ.mol-1 |
| C、+488.3kJ.mol-1 |
| D、+244.15-488.3kJ.mol-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com