
| A. | IVA族元素氢化物沸点顺序是:GeH4>SiH4>CH4;则VA族元素氢化物沸点顺序也是:AsH3>PH3>NH3 | |
| B. | CH4是正四面体结构,则SiH4也是正四面体结构 | |
| C. | 锂与氧气反应:4Li+O2═2 Li2O,则钠与氧气反应:4Na+O2═2Na2O | |
| D. | CaCO3与稀硝酸反应生成CO2,则CaSO3与稀硝酸反应生成SO2 |
分析 A.氢化物的熔沸点与分子间作用力成正比,与氢键有关;
B.甲烷、硅烷中C、Si原子和H原子都能形成正四面体结构;
C.Li和氧气反应生成 Li2O,Na在空气中燃烧生成过氧化钠;
D.碳酸钙和稀硝酸反应生成二氧化碳,亚硫酸钙和稀硝酸发生氧化还原反应生成硫酸钙.
解答 解:A.氢化物的熔沸点与分子间作用力成正比,与氢键有关,碳族元素氢化物中都不含氢键,所以其氢化物熔沸点只与分子间作用力有关,则IVA族元素氢化物沸点顺序是:GeH4>SiH4>CH4;氮族元素中氨气含有氢键导致其熔沸点最高,则VA族元素氢化物沸点顺序也是:NH3>AsH3>PH3,故A错误;
B.甲烷、硅烷中C、Si原子和H原子都能形成正四面体结构,所以二者氢化物空间构型相同,故B正确;
C.Li和氧气反应生成 Li2O,Na在空气中燃烧生成过氧化钠,钠和氧气在没有条件的条件下反应生成氧化钠,故C错误;
D.CaCO3没有还原性,则CaCO3和稀硝酸反应生成二氧化碳,CaSO3具有还原性,则CaSO3和稀硝酸发生氧化还原反应生成CaSO4,故D错误;
故选B.
点评 本题考查探究化学规律,为高频考点,侧重考查学生分析判断及总结归纳能力,明确物质性质、物质结构是解本题关键,注意规律中的反常现象,注意A中氢化物稳定性与化学键有关,氢化物熔沸点与分子间作用力和氢键有关,为易错点.


科目:高中化学 来源: 题型:选择题
| A. | 137表示质量数 | B. | 137表示质子数 | ||
| C. | 该原子质子数大于中子数 | D. | 55表示中子数 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 序号 | 实验方案 | 实验现象 |
| ① | 向盛有少量溴化钠溶液的试管中滴加少量新制氯水,振荡,再加入少量四氯化碳,振荡后静置 | 液体分为两层,下层 呈橙红色 |
| ② | 向盛有少量碘化钠溶液的试管中滴加少量新制溴水,振荡,再加入少量四氯化碳,振荡后静置 | 液体分为两层,下层 呈紫红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径 | B. | 单质熔沸点 | ||
| C. | 与水或酸反应置换氢气的剧烈程度 | D. | 最高价氧化物对应水化物的碱性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
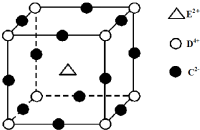 周期表中前四周期元素A、B、C、D、E的原子序数依次增大.元素A的单质有多种同素异形体,其中一种是天然存在的最坚硬的固体;元素C的原子最外层电子数是其内层的3倍;基态D原子的价电子排布为(n+1)dn(n+2)sn;基态E2+的3d轨道中有5个电子.
周期表中前四周期元素A、B、C、D、E的原子序数依次增大.元素A的单质有多种同素异形体,其中一种是天然存在的最坚硬的固体;元素C的原子最外层电子数是其内层的3倍;基态D原子的价电子排布为(n+1)dn(n+2)sn;基态E2+的3d轨道中有5个电子.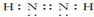 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲苯分子中的所有原子可能共平面 | B. |  分子中的所有原子可能共平面 分子中的所有原子可能共平面 | ||
| C. | 乙烷分子中的所有原子可能共平面 | D. | 二氯甲烷分子为正四面体结构 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com