
【题目】(1)如图所示,Zn、Cu与稀硫酸形成的原电池装置中,负极材料为 ,负极反应式为 ;正极材料为 ,正极反应式为 。

(2)在下列事实中,各是什么因素影响了化学反应速率?请填写对应序号:
A.催化剂 B.反应物的性质
C.反应温度 D.反应物的浓度
①同浓度、同体积的盐酸放入同样大小的锌粒和镁条,产生气体有快有慢:
②同样大小的石灰石分别与0.1 mol·L-1的盐酸和1 mol·L-1的盐酸反应,速率不同:
③夏天食品容易变质,而冬天不易发生该现象:
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】1mol某烃在氧气中充分燃烧,需要消耗氧气179.2L(标准状况下)。它在光照的条件下与氯气反应能生成三种不同的一氯取代物。该烃的结构简式是 ( )
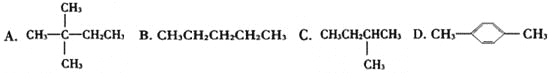
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】大功率的镍氢电池使用在油电混合动力车辆中。镍氢电池NiMH电池正极板材料为NiOOH,负极板材料为吸氢合金,下列关于该电池的说法中正确的的是
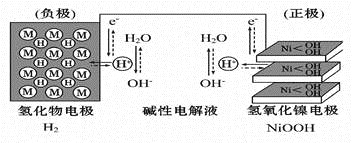
A. 放电时电池内部H+向负极移动
B. 充电时,将电池的负极与外接电源的正极相连
C. 充电时阳极反应为Ni(OH)2+ OH-- e-=NiOOH+H2O
D. 放电时负极的电极反应式为MHn-ne-= M+nH+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】食品安全关系国计民生,影响食品安全的因素很多。
(1)聚偏二氯乙烯(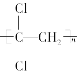 )具有超强阻隔性能,可作为保鲜食品的包装材料。它是由________(写结构简式)发生加聚反应生成的。
)具有超强阻隔性能,可作为保鲜食品的包装材料。它是由________(写结构简式)发生加聚反应生成的。
(2)劣质植物油中的亚油酸[CH3(CH2)4—CH2===CH—CH2—CH===CH—(CH2)7COOH]含量很低。下列关于亚油酸的说法中,正确的是________。
A.分子式为C18H34O2
B.一定条件下能与甘油(丙三醇)发生酯化反应
C.能和NaOH溶液反应
D.能使酸性KMnO4溶液褪色
(3)假酒中甲醇(CH3OH)含量超标,请写出Na和甲醇反应的化学方程式: ___________。
(4)劣质奶粉中蛋白质含量很低。蛋白质水解的最终产物是__________________。
(5)在淀粉中加入吊白块制得的粉丝有毒。淀粉最终的水解产物是葡萄糖。请设计实验证明淀粉已经全部水解,写出操作、现象和结论:_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】酯类是工业上重要的有机原料,具有广泛用途。
乙酸苯甲酯(![]() )对花香和果香的香韵具有提升作用,故常用于化妆品和食品工业。乙酸苯甲酯的合成路线如下:
)对花香和果香的香韵具有提升作用,故常用于化妆品和食品工业。乙酸苯甲酯的合成路线如下:
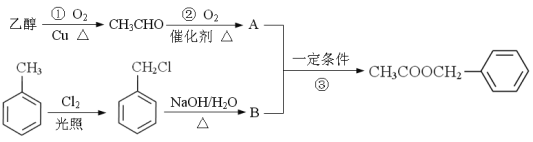
已知:R-Cl![]() R-OH , R- 为烃基)
R-OH , R- 为烃基)
(1)A的结构简式为 ,B所含官能团的名称是 ;
反应③的类型是 。
(2)下列物质中能与A的水溶液反应的是 。(填序号)
A.CaCO3 B.NaOH C.CuSO4 D.NaCl E.Zn
任写一个以上能与A的水溶液反应的化学方程式 。
![]() (3)下列转化中 (填序号)原子的理论利用率为100%,符合绿色化学的要求。
(3)下列转化中 (填序号)原子的理论利用率为100%,符合绿色化学的要求。
A.乙醇制取乙醛
B.由![]() 制备
制备
C.2CH3CHO + O2![]() 2A
2A
(4)写出反应①的化学反应方程式 。
反应①的反应类型是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:物质A中只含有C、H、O三种元素,一定条件下能发生银镜反应;物质C的相对分子质量为104。A与其他物质之间的转化关系如下图所示:
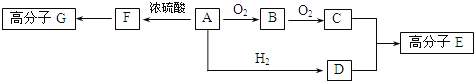
请回答下列问题:
(1)F中含有的官能团有________;G的结构简式为________。
(2)一定条件下B发生银镜反应的化学方程式为________。
(3)C、D在一定条件下反应还能生成环状化合物,其化学反应方程式为________。
(4)A的同分异构体很多,写出与A中所含官能团不同,但能与NaOH溶液反应的各种同分异构体的结构简式:________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Al、Fe、Cu都是重要的金属元素,下列说法正确的是
A.三者对应的氧化物均为碱性氧化物
B.三者的单质放置在空气中均只生成氧化物
C.Fe2O3 与Fe3O4互为同素异形体
D.常温下三者加入浓硫酸中均无明显现象
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W核电荷数依次增大,X、Z同主族,Z、W同周期,四种元素的原子序数之和为37,在周期表中X是原子半径最小的元素,Y的最外层电子数是内层电子数的3倍。
(1)W在周期表中的位置是第 周期第 族。
(2)X与Y 能形成具有18个电子的化合物,此化合物的电子式为 。
(3)X、Y、Z三种元素组成的化合物中存在 (填“化学键”名称)。
(4)Z单质在W单质中燃烧火焰的颜色是 ;Z单质在空气燃烧生成的物质中,共价键的类型为 ;Y、Z、W形成的某种化合物类型是 化合物(填“共价”或“离子”)。
(5)X和Y形成的化合物沸点 (填“高”或“低”)于X和W形成的化合物沸点。
(6)W单质的水溶液滴入KBr溶液中的现象是 ;Z、W两种元素的最高价氧化物对应水化物溶液之间反应的离子方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某无色溶液中可能含有Na+、K+、NH4+、Mg2+、Cu2+、SO42-、SO32-、Cl-、Br-、CO32-中的若干种,离子浓度都为0.1mol·L-1。往该溶液中加入过量的BaCl2和盐酸的混合溶液,无白色沉淀生成。某同学另取少量原溶液,设计并完成如下实验:

则关于原溶液的判断中正确的是
A. 若步骤中Ba(NO3)2和HNO3溶液改用BaCl2和盐酸的混合溶液,则对溶液中离子的判断无影响
B. 无法确定原溶液中是否存在Cl-
C. 肯定存在的离子是SO32-、Br-,是否存在Na+、K+需要通过焰色反应来确定
D. 肯定不存在的离子是Mg2+、Cu2+、SO42-、CO32-,是否含NH4+另需实验验证
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com