
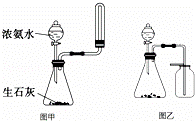
下列关于实验的说法错误的是( )
|
| A. | “硝基苯制备”实验中,将温度计插入水浴,但水银球不能与烧杯底部和烧杯壁接触 |
|
| B. | 除去干燥CO2中混有的少量SO2,可将混合气体依次通过盛有酸性KMnO4溶液、浓硫酸的洗气瓶 |
|
| C. | 选择合适的试剂,用图乙所示装置可分别制取并收集少量CO2和O2 |
|
| D. | 实验室用图甲所示的装置制取少量氨气 |
考点:
化学实验方案的评价.
专题:
实验评价题.
分析:
A.水浴加热时,温度计如插入烧杯底部和烧杯壁接触,测量温度会偏高,且水银球易破裂;
B.二氧化硫和与酸性高锰酸发生氧化还原反应;
C.可用盐酸和碳酸钠或用双氧水与二氧化锰分别制取二氧化碳和氧气,用向上排空法收集;
D.收集气体的试管不能用塞子塞住.
解答:
解:A.将温度计插入水浴,但水银球不能与烧杯底部和烧杯壁接触,防止测量温度会偏高,且水银球易破裂,故A正确;
B.二氧化硫和与酸性高锰酸发生氧化还原反应,可除去二氧化硫,用浓硫酸干燥可得纯净的二氧化碳气体,故B正确;
C.二氧化碳和氧气的密度比空气大,可用盐酸和碳酸钠或用双氧水与二氧化锰分别制取二氧化碳和氧气,用向上排空法收集,故C正确;
D.收集气体的试管不能用塞子塞住,防止压强过大而将塞子顶出,应用一团棉花塞在试管口,故D错误.
故选D.
点评:
本题考查化学实验方案的评价,涉及气体的制备、洗气等操作,为高考常见题型,侧重于学生的分析能力、实验能力和评价能力的考查,注意把握实验原理和操作方法,难度不大.


 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案科目:高中化学 来源: 题型:
化学和材料开发制造、科学研究、生产生活等密切相关.
(1)第十八届江苏省运动会于2014年9月19日在徐州奥体中心开幕,奥体中心建筑采用了世界领先的钢结构技术,建筑材料中还使用了大量的铝合金、玻璃等.
①工业上铁的冶炼是在 中进行的,主要原料有铁矿石,焦炭、空气、 等.
②下列有关铝合金性能的叙述正确的是 c (填字母).
a.密度大 b.强度小 c.耐腐蚀
③下列物质中,不是工业上制造玻璃的主要原料的是 (填字母).
a.水玻璃 b.二氧化硅 c.碳酸钠
(2)化工生产和科学研究中,经常需要配制一定物质的量浓度的溶液.
①在实验室,使用容量瓶来准确配制 、一定浓度的溶液.
②欲配制1.00mol/L的氯化钠溶液100mL,用不到的仪器是 (填“烧杯”、“玻璃棒”或“分液漏斗”).配制500mL0.l mol/L氢氧化钠溶液需要氢氧化钠的质量是 g.
③在溶液稀释前后,溶液的体积发生了变化,但溶液中 的物质的量不变.配制一定物质的量浓度的Na2CO3溶液时,下列操作正确的是 (填字母).
a.将称好的固体在烧杯中溶解,所得溶液冷至室温再转移到容量瓶中
b.定容时,如果加水超过了刻度线,用胶头滴管直接吸出多余的部分
c.定容摇匀后发现溶液液面低于刻度线,再补加少量蒸馏水至刻度线
(3)物质的结构决定物质的性质,物质的性质关系到物质的用途.
①以电解 为基础制备氯气等产品的工业称为氯碱工业.在实验室要将氯化钠溶液和氯化钾溶液区别开来,可以采用的方法是 .
②当分散剂是水或其他液体时,根据 直径大小的不同,可以将分散系分为浊液、胶体和溶液.在实验室区分胶体与溶液常用的一种物理方法为 .
③在生产中,人们曾用浓氨水来检验氯气管道是否漏气.如果氯气管道某处漏气,用浓氨水检查时就会产生白烟的现象,又知此时发生的是有氮气生成的置换反应,则此时发生反应的化学方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
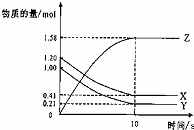
一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示.下列描述正确的是( )
|
| A. | 反应开始到10s,用Z表示的反应速率为 0.158mol/(L•s) |
|
| B. | 反应开始到10s,X的物质的量浓度减少了0.79mol/L |
|
| C. | 反应开始到10s时,Y的反应速率为0.0395mol/(L•s) |
|
| D. | 反应的化学方程式为:X(g)+Y(g)⇌Z(g) |
查看答案和解析>>
科目:高中化学 来源: 题型:
两个惰性电极插入500mL AgNO3溶液中,通电电解.当电解液的pH从6.0变为3.0时,(设电解过程中阴极没有H2放出,且电解液在电解前后体积变化可以忽略不计)电极上析出银的质量最大为( )
|
| A. | 27 mg | B. | 54 mg | C. | 106 mg | D. | 216 mg |
查看答案和解析>>
科目:高中化学 来源: 题型:
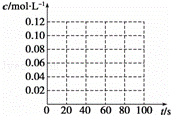
在100℃时,将0.40mol的二氧化氮气体充入2L真空的密闭容器中,每隔一段时间就对该容器内的物质进行分析,得到数据如表所示:
| 时间(s) | 0 | 20 | 40 | 60 | 80 |
| n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
| n(N2O4)/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
(1)在上述条件下,从反应开始直至20s时,二氧化氮的平均反应速率为 mol•L﹣1•s﹣1.
(2)n3 n4(填“>”、“<”或“=”),该反应的平衡常数为 (保留小数点后一位).
(3)若在相同情况下,最初向该容器中充入的是四氧化二氮气体,要达到上述同样的平衡状态,四氧化二氮的起始浓度是 mol•L﹣1,假设在80s时达到平衡,请在如图中画出并标明该条件下此反应中N2O4和NO2的浓度随时间变化的曲线.
(4)达到平衡后,如升高温度,气体颜色会变深,则升高温度后,反应2NO2(g)⇌Ν2O4(g)的平衡常数将 (填“增大”、“减小”或“不变”).
(5)达到平衡后,如向该密闭容器中再充入0.32mol氦气,并把容器体积扩大为4L,则平衡将 (填“向左移动”、“向右移动”或“不移动”).
查看答案和解析>>
科目:高中化学 来源: 题型:
如图示的装置中,把X溶液逐滴滴下与Y物质反应,若X为浓硫酸,Y为第三周期金属元素中常温下与水难反应的单质.Z为品红溶液.实验中观察到Z褪色.则Y为( )

A. Na B. Mg C. Al D. Mg或Al
查看答案和解析>>
科目:高中化学 来源: 题型:
将51.2g Cu完全溶于适量浓硝酸中,收集到氮的氧化物(含NO、N2O4、NO2)的混合物共0.8mol,这些气体恰好能被500mL 2mol/L NaOH溶液完全吸收,生成含NaNO3和NaNO2的盐溶液,其中NaNO2的物质的量为( )
A. 0.2mol B. 0.6mol C. 0.8mol D. 1.0mol
查看答案和解析>>
科目:高中化学 来源: 题型:
肯定属于同族元素且性质相似的是( )
|
| A. | 原子核外电子排布式:A为1s22s2,B为1s2 |
|
| B. | 结构示意图:A为 |
|
| C. | A原子基态时2p轨道上有1个未成对电子,B原子基态时3p轨道上也有1个未成对电子 |
|
| D. | A原子基态时2p轨道上有一对成对电子,B原子基态时3p轨道上也有一对成对电子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com