
| A.负极反应为:Fe=Fe2++2e- |
| B.正极反应为:O2+4e-+4H+=2H2O |
| C.腐蚀过程中,电子从负极流向正极 |
| D.钢柱在水下的部分比在空气与水交界处更容易发生吸氧腐蚀 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:不详 题型:单选题
| A.与电源正极相连的是电解槽的阴极 |
| B.与电源负极相连的是电解槽的阴极 |
| C.在电解槽的阳极发生氧化反应 |
| D.电子从电源的负极沿导线流入电解槽的阴极 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.镀锌铁片比镀锡铁片更耐腐蚀 |
| B.远洋海轮的尾部装上一定数量的锌板 |
| C.常温条件下,在空气中铝不易被腐蚀 |
| D.用锌与硫酸制氢气时,往硫酸中滴少量硫酸铜 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.④>①>③>②>⑤ | B.②>⑤>①>④>③ | C.⑤>①>③>②>④ | D.⑤>④>①>②>③ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.脱氧过程是吸热反应,可降低温度,延长糕点保质期 |
| B.脱氧过程中铁做原电池负极,电极反应为Fe-2e-═Fe2+ |
| C.脱氧过程中碳做原电池正极,电极反应为2H2O+O2+4e-═4OH- |
| D.含有1.12g铁粉的脱氧剂,理论上最多能吸收氧气336mL(标准状况) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
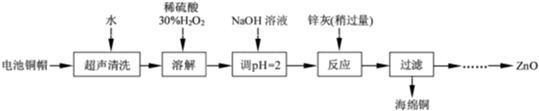
| 开始沉淀的pH | 沉淀完全的pH | |
| Fe3+ | 1.1 | 3.2 |
| Fe2+ | 5.8 | 8.8 |
| Zn2+ | 5.9 | 8.9 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com