
| 54g |
| 18g/mol |
| 44.8L |
| 22.4L/mol |
| 46-2×12-6×1 |
| 16 |


科目:高中化学 来源: 题型:
| A、用灼烧并闻气味的方法区别纯棉织物和纯羊毛织物 |
| B、用食醋、石灰水验证蛋壳中含有碳酸盐 |
| C、用米汤检验食用加碘盐(含KIO3)中含有碘 |
| D、用鸡蛋白、食盐、水完成蛋白质的溶解、盐析实验 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 现有一定质量的某种碱金属的两种碳酸盐(正盐和酸式盐)组成的混合物加水溶解后向其中所得溶液逐滴加入一定浓度的稀盐酸,并同时记录放出二氧化碳气体的体积(标准状况)和消耗盐酸的体积,得到如图所示的曲线.下列说法不正确的是( )
现有一定质量的某种碱金属的两种碳酸盐(正盐和酸式盐)组成的混合物加水溶解后向其中所得溶液逐滴加入一定浓度的稀盐酸,并同时记录放出二氧化碳气体的体积(标准状况)和消耗盐酸的体积,得到如图所示的曲线.下列说法不正确的是( )| A、由图可知正盐和酸式盐的物质的量之比为3:2 |
| B、由图可知含正盐物质的量为0.003mol |
| C、盐酸的浓度为0.25mol/L |
| D、两种盐的总物质的量为0.05mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Mg和Fe |
| B、Fe和Zn |
| C、Mg和Al |
| D、Al和Fe |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、
| ||
B、
| ||
C、
| ||
D、
|
查看答案和解析>>
科目:高中化学 来源: 题型:
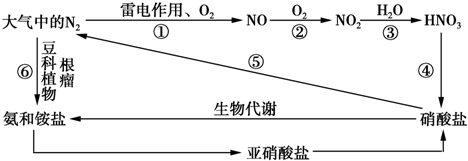
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
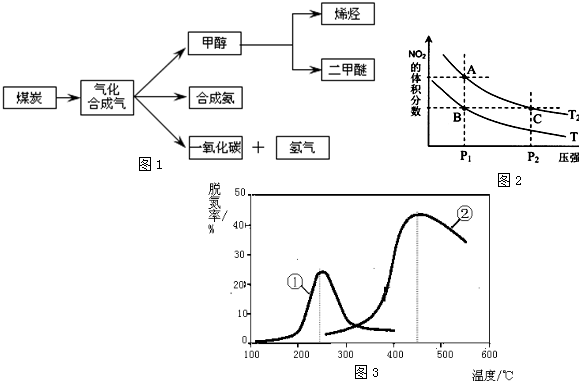
| [H2][CO] |
| [H2O] |
| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com