
| A. | Al3+ | B. | Mg2+ | C. | Cl- | D. | Ba2+ |
分析 某溶液中含有NO3-、SO42-、Fe3+、H+、M,溶液不显电性,其物质的量浓度之比为c(NO3-):c(SO42-):c(Fe3+):c(H+):c(M)=2:3:1:3:1,利用电荷守恒及离子的共存来计算解答.
解答 解:已知物质的量之比为n(NO3-):n(SO42-):n(Fe3+):n(H+):n(M)=2:3:1:3:1,设各离子的物质的量分别为2mol、3mol、1mol、3mol、1mol,
则阴离子所带电荷n(NO3-)+2×n(SO42-)=2mol+2×3mol=8mol,
阳离子所带电荷3×n(Fe3+)+n(H+)=3×1mol+3mol=6mol,
阴离子所带电荷大于阳离子所带电荷,则M一定为阳离子,因M的物质的量为1mol,根据电荷守恒,则离子应带2个正电荷,
又因Ba2+与SO42-反应生成沉淀而不能大量共存,则B符合,
故选B.
点评 本题考查离子共存问题,为高频考点,侧重于学生的分析能力的考查,题目难度中等,注意根据电荷守恒判断M应为阳离子,结合离子反应问题判断.


 学练快车道快乐假期寒假作业系列答案
学练快车道快乐假期寒假作业系列答案 新思维寒假作业系列答案
新思维寒假作业系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 无隔膜电解饱和NaCl溶液所得产物之一是“84”消毒液中的有效成分NaClO | |
| B. | 钢铁腐蚀的负极反应为:Fe-3e-=Fe3+ | |
| C. | 因为合金在潮湿的空气中易形成原电池,所以合金耐腐蚀性都较差 | |
| D. | H2-O2燃料电池中电解液为H2SO4,则正极反应式为:O2+4e-=2O2- |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
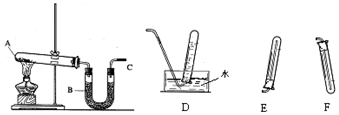
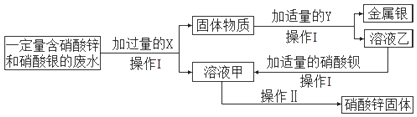
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在过氧化钠与水的反应中,固体每增重mg,转移电子的数目为mNA | |
| B. | 标准状况下,2.24L Cl2与过量稀NaOH溶液反应,转移的电子总数为0.2NA | |
| C. | 已知反应:2NH3+NO+NO2═2N2+3H2O,每生成2mol N2转移的电子数目为6NA | |
| D. | 标准状况下,1 mol CCl4的体积为22.4L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 现象或事实 | 解释 |
| A | 明矾可用作净水剂 | 明矾能水解生成Al(OH)3 胶体 |
| B | FeCl3溶液可用于腐蚀铜制印刷电路 | FeCl3 溶液能与Cu反应 |
| C | SO2可用于漂白纸浆 | SO2 具有氧化性 |
| D | 酸性或碱性表示食物不宜放在铝锅中久置 | 铝能与酸或碱反应 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
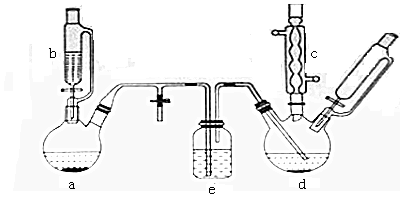
| 有机物 | 苯 | 氯苯 | 邻二氯苯 | 间二氯苯 | 对二氯苯 |
| 沸点/℃ | 80 | 132.2 | 180.4 | 173.0 | 174.1 |
| 流失项目 | 蒸气挥发 | 二氯苯 | 其他 | 合计 |
| 苯流失量(kg/I) | 28.8 | 14.5 | 56.7 | 100 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com