
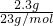 =0.1ml,根据钠元素守恒可知,溶液中生成的n(NaOH)=n(Na)=0.1mol,故NaOH浓度增大为
=0.1ml,根据钠元素守恒可知,溶液中生成的n(NaOH)=n(Na)=0.1mol,故NaOH浓度增大为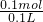 =1mol/L,故反应后NaOH的物质的量浓度为1mol/L+0.3mol/L=1.3mol/L,
=1mol/L,故反应后NaOH的物质的量浓度为1mol/L+0.3mol/L=1.3mol/L, 计算钠的物质的量,根据钠元素守恒可知,溶液中生成的NaOH的物质的量等于Na的物质的量,根据c=
计算钠的物质的量,根据钠元素守恒可知,溶液中生成的NaOH的物质的量等于Na的物质的量,根据c= 计算氢氧化钠溶液的浓度增大,据此计算反应后溶液中氢氧化钠溶液的物质的量浓度.
计算氢氧化钠溶液的浓度增大,据此计算反应后溶液中氢氧化钠溶液的物质的量浓度.

科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 金属离子 | 开始形成氢氧化物沉淀的pH | 完全形成氢氧化物沉淀的pH |
| Fe2+ | 7.0 | 9.0 |
| Fe3+ | 1.9 | 3.2 |
| Cu2+ | 4.7 | 6.7 |
| ||
| ||

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解


| 化学式 | Ca(OH)2 | CaSO4 | BaCO3 | BaSO4 | MgCO3 | Mg(OH)2 |
| Ksp | 1.0×10一4 | 7.1×10一5 | 8.1×10一9 | 1.08×10一10 | 3.5×10一5 | 1.6×10一11 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com