
【题目】以环已醇( ![]() )为原料制取己二酸[HOOC(CH2)4COOH]的实验流程如下:
)为原料制取己二酸[HOOC(CH2)4COOH]的实验流程如下:
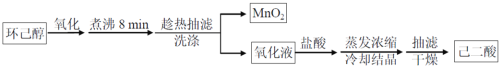
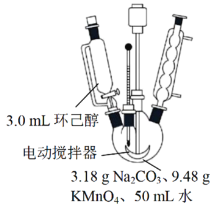
其中“氧化”的实验过程:在250mL四口烧瓶中加入50mL水和3.18g碳酸钠,低速搅拌至碳酸钠溶解,缓慢加入9.48g(约0.060mol)高锰酸钾,按图示搭好装置,打开电动搅拌,加热至35℃,滴加3.2mL(约0.031mol)环己醇,发生的主要反应为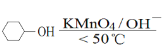 KOOC(CH2)4COOK ΔH<0
KOOC(CH2)4COOK ΔH<0
(1)“氧化”过程应采用___________加热。(填标号)
A.热水浴 B.酒精灯 C.煤气灯 D.电炉
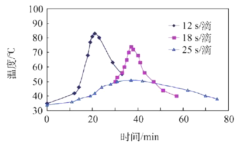
(2)“氧化”过程,不同环己醇滴加速度下,溶液温度随时间变化曲线如图,为保证产品纯度,应选择的滴速为___________s/滴。
(3)为证明“氧化”反应已结束,在滤纸上点1滴混合物,若观察到_____,则表明反应已经完成.
(4)“趁热抽滤”后,用________进行洗涤。
(5)室温下,相关物质溶解度如表。“蒸发浓缩”过程中,为保证产品纯度及产量,应浓缩溶液体积至__(填标号)。
化学式 | 己二酸 | NaCl | KCl |
溶解度g/100g 水 | 1.44 | 35.1 | 33.3 |
A.5mL B. 10mL C. 15mL D. 20mL
(6)称取已二酸(Mr=146g/mol)样品0.2920g,用新煮沸的50mL热水溶解,滴入2滴酚酞试液,用0.2000 mol/LNaOH溶液滴定至终点,进行平行实验及空白实验后,消耗NaOH的平均体积为19.70mL.
①NaOH溶液应装于_______ (填仪器名称).
②己二酸样品的纯度为___________.
【答案】A 25 未出现紫红色 热水 C 碱性滴定管 98.5%
【解析】
(1)由题可知,“氧化”过程中反应温度为35℃,因此应采用热水浴加热,
故答案为:A;
(2)为保证反应温度的稳定性(小于50℃),由图可知,最好采用25s/滴,
故答案为:25;
(3)0.031mol环己醇完全氧化为KOOC(CH2)4COOK,失去电子0.031mol×8=0.248mol,而0.06mol高锰酸钾在碱性条件下完全反应转移电子0.18mol(KMnO4→MnO2),由此可知,高锰酸钾先消耗完,若证明“氧化”反应已结束,在滤纸上点1滴混合物,若观察到未出现紫红色,则说明已经完成,
故答案为:未出现紫红色;
(4)趁热抽滤后,应用热水进行洗涤,
故答案为:热水;
(5)溶液中杂质KCl的质量为:0.06mol×(39+35.5)g/mol=4.47g,完全溶解KCl所需水的体积为:![]() mL=13.42mL,当杂质全部溶解在水中时,己二酸能够最大限度析出,故应浓缩溶液体积至15mL,
mL=13.42mL,当杂质全部溶解在水中时,己二酸能够最大限度析出,故应浓缩溶液体积至15mL,
故答案为:C;
(6)NaOH溶液应装于碱式滴定管;由HOOC(CH2)4COOH+2NaOH=2H2O+NaOOC(CH2)4COONa可知,n(NaOH)=![]() n(HOOC(CH2)4COOH),故己二酸样品的纯度为
n(HOOC(CH2)4COOH),故己二酸样品的纯度为![]() =98.5%,
=98.5%,
故答案为:碱式滴定管;98.5%。


科目:高中化学 来源: 题型:
【题目】(1)O3将I-氧化成I2的过程由3步反应组成:
①I-(aq)+O3(g)=IO-(aq)+O2(g) △H1
②IO-(aq)+H+(aq)![]() HOI(aq) △H2
HOI(aq) △H2
③HOI(aq)+I-(aq)+H+(aq)![]() I2(aq)+H2O(l) △H3
I2(aq)+H2O(l) △H3
总反应的热化学方程式为___。
(2)AgCl和水的悬浊液中加入足量的Na2S溶液并振荡,结果白色固体完全转化为黑色固体:写出白色固体转化成黑色固体的化学方程式:___。
(3)向Na2CO3溶液中滴加酚酞呈红色的原因是___(用离子方程式表示);溶液中各离子浓度由大到小的顺序___;向此溶液中加入AlCl3溶液,观察到的现象是__,反应的离子方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的制备合理的是: ( )
①将氯化铝溶液与硫化钾溶液混和后过滤来制备硫化铝
②将过量的铁与氯气加热反应制备氯化亚铁
③在配制FeSO4溶液时常向其中加入一定量铁粉和稀硫酸
④铜先氧化成氧化铜,再与硫酸反应来制取硫酸铜
⑤将45mL水加入到盛有5g NaCl的烧杯中,搅拌溶解来配制50g质量分数为5%的NaCl溶液
A.①④B.②③C.③④D.全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:![]() ,以下是用苯作原料制备一系列化合物的转化关系图:
,以下是用苯作原料制备一系列化合物的转化关系图:
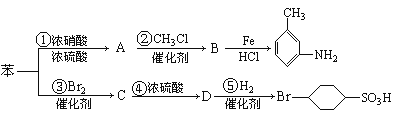
(1)苯转化为A的化学方程式是______________________________________________。
(2)B的结构简式为_______________。
(3)有机物C的所有原子______(填“是”或“不是”)在同一平面上。
(4)D分子苯环上的一氯代物有_________种。
(5)在上述反应①②③④⑤中,属于取代反应的是_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将0.48g镁粉分别加入10.0mL下列溶液,反应6小时,用排水法收集产生的气体,溶液组成与H2体积(已换算成标准状况)的关系如下表。下列说法不正确的是
实验 | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
溶液组成 | H2O | 1.0mol/L NH4Cl | 0.1mol/L NH4Cl | 1.0mol/L NaCl | 1.0mol/L NaNO3 | 0.8mol/L NH4Cl+ 0.2mol/L NH3·H2O | 0.2mol/L NH4Cl+ 0.8mol/L NH3·H2O |
V/ml | 12 | 433 | 347 | 160 | 14 | 401 | 349 |
A.由实验2、3可得,![]() 浓度越大,镁和水反应速率越快
浓度越大,镁和水反应速率越快
B.由实验1、4、5可得,Cl-对镁和水的反应有催化作用
C.由实验3、7可得,反应过程产生的Mg(OH)2覆盖在镁表面,减慢反应
D.无论酸性条件还是碱性条件,![]() 都能加快镁和水的反应
都能加快镁和水的反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一铁的氧化物样品,用140 mL 5 mol·L-1的盐酸恰好完全溶解,所得溶液还能与通入的0.56 L氯气(标准状况)反应,使Fe2+全部转化为Fe3+,则此氧化物为
A.Fe2O3B.Fe3O4C.Fe4O5D.Fe5O7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是(ΔH 的数值均正确) ( )
A.S(s)+![]() O2(g)===SO3(g) △H=-315kJ·mol-1(燃烧热)
O2(g)===SO3(g) △H=-315kJ·mol-1(燃烧热)
B.已知 H+(aq)+OH-(aq)===H2O(l) △H= -57.3kJ·mol-1,则 H2SO4 和 Ba(OH)2 反应的反应热 H=2×(-57.3) kJ·mol-1
C.已知稀溶液中,H+(aq)+OH-(aq)===H2O(l) △H= -57.3kJ·mol-1,则稀醋酸与稀氢氧化钠溶液反应生成 1mol 水时放出 57.3kJ 的热量
D.CO(g)的燃烧热是 283.0kJ·mol-1,则 2CO2(g)===2CO(g)+O2(g) 反应的反应热 △H=+2×283.0kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】3.04 g铜镁合金完全溶解于100mL密度为1.40gmL-1、质量分数为63%的浓硝酸中,得到NO2 和N2O4的混合气体2240 mL(标准状况),向反应后的溶液中加入2.00 mol·L-1 NaOH溶液,当金属离子全部沉淀时,得到5.08g沉淀。下列说法不正确的是
A.得到5.08g沉淀时,加入NaOH溶液的体积是600mL
B.该合金中铜与镁的物质的量之比是2:l
C.该浓硝酸中HNO3的物质的量浓度是14.0 mol·L-1
D.NO2和N2O4的混合气体中,NO2的体积分数是80%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对如表实验现象或操作的解释或结论错误的是![]()
编号 | 现象或操作 | 解释或结论 |
A | KI淀粉溶液中滴入氯水变蓝,再通入 |
|
B | 在 | 盐类水解反应是吸热反应 |
C | 向少量火柴头的浸泡溶液中滴加 | 火柴头里含有氯元素 |
D | 蒸馏时,温度计的球泡应靠近蒸馏烧瓶支管口处 | 此位置指示的是馏出物的沸点 |
A.AB.BC.CD.D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com