
| 编号 | A | B→C化学方程式 |
| ① | ||
| ② |
分析 (1)若A的水溶液能使湿润的红色石蕊试纸变蓝,D的稀溶液能使蓝色的湿润石蕊试纸变红,则A为NH3,B为NO,C为NO2,D为HNO3;
(2)若A为活泼金属元素的单质,D为强碱,焰色反应显黄色,则A为Na,B为Na2O,C为Na2O2,D为NaOH;
(3)若A为常见的非金属单质,A可以为S、N2等,则B为SO2、NO,C为SO3、NO2,D为H2SO4、HNO3等,据此答题.
解答 解:(1)若A的水溶液能使湿润的红色石蕊试纸变蓝,D的稀溶液能使蓝色的湿润石蕊试纸变红,则A为NH3,B为NO,C为NO2,D为HNO3,A→B转化的化学方程式:4NH3+5O2 $\frac{\underline{催化剂}}{△}$4NO+6H2O,
故答案为:NH3;4NH3+5O2 $\frac{\underline{催化剂}}{△}$4NO+6H2O;
(2)若A为活泼金属元素的单质,D为强碱,焰色反应显黄色,则A为Na,B为Na2O,C为Na2O2,D为NaOH,A跟水发生反应的离子方程式为:2Na+2H2O═2Na++2OH-+H2↑,
故答案为:Na2O2;2Na+2H2O═2Na++2OH-+H2↑;
(3)若A为常见的非金属单质,①A为S时,则B为SO2,C为SO3,D为H2SO4,B→C的化学方程式分别为2SO2+O2$\frac{\underline{催化剂}}{△}$2SO3,②A为N2时,则B为NO,C为NO2,D为HNO3,B→C的化学方程式为2NO+O2=2NO2,
故答案为:①S;2SO2+O2$\frac{\underline{催化剂}}{△}$2SO3;②N2;2NO+O2=2NO2;
点评 本题考查元素化合物的推断,涉及S、N、Na元素单质及其化合物性质与转化,需要学生熟练掌握元素化合物知识,注意相关基础知识的积累,难度不大.


科目:高中化学 来源: 题型:选择题
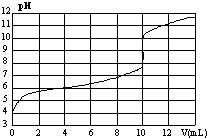 室温下,用某浓度NaOH溶液滴定一元酸HA的滴定曲线如图所示(横坐标为滴入NaOH的体积,纵坐标为所得混合液的pH).下列判断正确的是
室温下,用某浓度NaOH溶液滴定一元酸HA的滴定曲线如图所示(横坐标为滴入NaOH的体积,纵坐标为所得混合液的pH).下列判断正确的是| A. | HA的浓度为1×10-4mol•L-1 | B. | 实验时可选甲基橙作指示剂 | ||
| C. | pH=7时,溶液中c(Na+)>c(A-) | D. | V=10mL,酸碱恰好中和 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
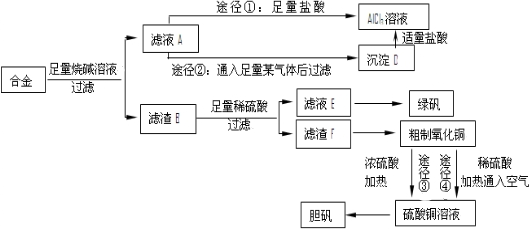
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 阴极发生的电极反应为:2H++2e-=H2↑ | |
| B. | 在阳极室,通电后溶液逐渐由橙色变为黄色,是因为阳极区H+浓度增大,使平衡2CrO42-+2H+?Cr2O72-+H2O向右移动 | |
| C. | 该制备过程总反应的化学方程式为:4K2CrO4+4H2O$\frac{\underline{\;通电\;}}{\;}$2K2Cr2O7+4KOH+2H2↑+O2↑ | |
| D. | 测定阳极液中K和Cr的含量,若K与Cr的物质的量之比为d,则铬酸钾的转化率为2-d |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向稀HNO3中滴加Na2SO3溶液:SO32-+2H+═SO2↑+H2O | |
| B. | 向Na2SiO3溶液中通入过量SO2:SiO32-+SO2+H2O═H2SiO3↓+SO32- | |
| C. | 向Al2(SO4)3溶液中加入过量的NH3•H2O:Al3++4NH3•H2O═AlO2-+4NH4++2H2O | |
| D. | 向CuSO4溶液中加入Na2O2:2Na2O2+2Cu2++2H2O═4Na++2Cu(OH)2↓+O2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
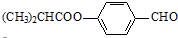 .合成M的一种途径如下
.合成M的一种途径如下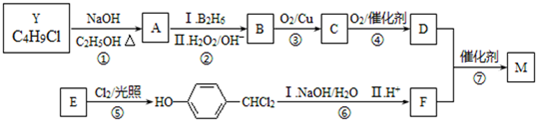
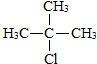 .
.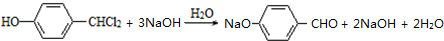 .
. .
.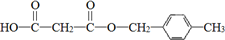 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;1mol O22+中含有的π键数目为2NA.
;1mol O22+中含有的π键数目为2NA.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用滤纸称量NaOH固体 | |
| B. | 移液前容量瓶内有水珠 | |
| C. | 摇匀后,液面低于刻度线,再加水至刻度线 | |
| D. | 定容时,俯视刻度线 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解法制铝工艺的发明使铝在生产生活中得以迅速普及 | |
| B. | 合成氨工艺的开发缓解了人类有限耕地资源与庞大粮食需求的矛盾 | |
| C. | 研究影响化学反应速率的因素对提高可逆反应的限度具有决定性作用 | |
| D. | 燃料电池的能量转换效率高具有广阔的前景 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com