
 已知水在25℃和95℃时,其电离平衡曲线如图所示:
已知水在25℃和95℃时,其电离平衡曲线如图所示:

 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
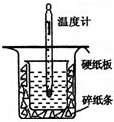 中和热的测定是高中重要的定量实验.取0.55mol/L的NaOH溶液50mL与0.50mol/L的盐酸50mL置于图所示的装置中进行中和热的测定实验,回答下列问题
中和热的测定是高中重要的定量实验.取0.55mol/L的NaOH溶液50mL与0.50mol/L的盐酸50mL置于图所示的装置中进行中和热的测定实验,回答下列问题| 实验序号[来源:学#科#网] | 起始温度t1/℃ | 终止温度(t2)/℃ | 温差(t2-t1)/℃ | ||
| 盐酸 | NaOH溶液 | 平均值 | |||
| 1 | 25.1 | 24.9 | 25.0 | 28.3 | 3.3 |
| 2 | 25.1 | 25.1 | 25.1 | 28.6 | 3.5 |
| 3 | 25.1 | 25.1 | 25.1 | 27.1 | 2.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| c(Ca2+) |
| c(Mn2+) |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、X、Y、Z三种元素中,Y的非金属性最强 |
| B、Y的氢化物的稳定性比Z的氢化物强 |
| C、Z的最高正化合价为+6 |
| D、常压下Z的单质的熔点比Y的低 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向1mol?L-1明矾溶液50mL中滴入数滴0.1mol?L-1Ba(OH)2溶液Al3++2 SO42-+2Ba2++3OH-=Al(OH)3↓+2BaSO4↓ |
| B、将1mol?L-1 NaAlO2溶液和1.5mol?L-1的HCl溶液等体积互相均匀混合6AlO2-+9H++3H2O=5Al(OH)3↓+Al3+ |
| C、甲烷的标准燃烧热为-890.3kJ?mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890.3kJ?mol-1 |
| D、将少量CO2气体通入NaClO溶液中:CO2+H2O+2ClO-=CO32-+2HClO |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、二氧化硫的水溶液能使紫色石蕊试液变红,说明它能和水反应生成H2SO3 |
| B、二氧化硫能漂白某些物质,说明它具有氧化性 |
| C、将足量二氧化硫通入酸性高锰酸钾试液中,溶液褪色,说明二氧化硫具有还原性 |
| D、实验室可用浓硫酸干燥二氧化硫气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氮化镁的化学式:MgN | ||||
B、中子数为18的氯原子:
| ||||
| C、Ca(OH)2的电离方程式:Ca(OH)2═Ca2++2OH- | ||||
D、铁在氯气中燃烧:2Fe+3Cl2
|
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com