
【题目】下列电子排布图所表示的元素原子中,其能量处于最低状态的是 ( )
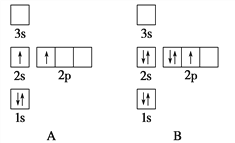
A. A B. B C. C D. D
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
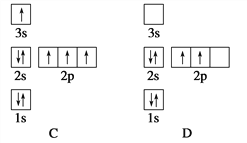
【题目】如图表示不同化学元素所组成的化合物,以下说法不正确的是( )
A. 若①是某种大分子的基本组成单位,则①是氨基酸
B. 若②是生命活动的主要能源物质,则②是糖类
C. 若②是细胞中的储能物质,则②一定是脂肪
D. 若③是携带遗传信息的大分子物质,则③一定是核酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D、E、F六种化合物,它们之间的反应关系如下所示:
①A+B→C+E ②C+NaOH→蓝色沉淀D+F
③D![]() A+E ④F+Ba(NO3)2→白色沉淀+NaNO3
A+E ④F+Ba(NO3)2→白色沉淀+NaNO3
回答下列问题:
(1)写出它们的化学式:
A____________ B____________ C____________
D____________ E____________ F____________
(2)写出①④反应的离子方程式:
①__________________。④_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、X 均为中学常见的单质或化合物,它们之间有如下转化关系(副产物已略去)。 试回答:
![]()
(1)若 X 是气体单质,则 A 可能是_____.
a.C b.Al c.Na d.Fe
(2)若 X 是金属单质,向 C 的水溶液中滴加 AgNO3 溶液,产生不溶于稀 HNO3 的白色沉淀;X 在 A
中可以燃烧。
①B 的化学式为_____;C 溶液在贮存时应加入少量 X,理由是(用必要的文字和离子方程式 表示)_________。
②向 C 的溶液中加入氢氧化钠溶液,现象是_________;写出涉及到的氧化还原反应的 化学方程式_____。
(3)若 A、B、C 为含有同种金属元素的化合物,X 为强酸或强碱溶液,则 B 的化学式为_____; 反应②的离子方程式为__________________或________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硅、硼、铜、硒的单质及化合物在现代工业生产中有着广泛应用。回答下列问题:
(1)基态Cu+的核外价层电子排布式为_______________;Be、B、Al的第一电离能由大到小的顺序是______________________________。
(2)硒、硅均能与氢元素形成气态氢化物,若“Si-H”中共用电子对偏向氢元素,氢气与硒反应时单质硒是氧化剂,则硒与硅的电负性相对大小为Se___ Si(填“>”、“<”)。
(3)SeO32-中Se原子的杂化类型为______,与其互为等电子体的一种分子的分子式是______________。
(4)CuSO4和Cu(NO3)2是自然界中重要的铜盐,向CuSO4熔液中加入过量稀氨水,产物的外界离子的空间构型为_________,Cu(NO3)2中的化学键除了σ键外,还存在_______________。
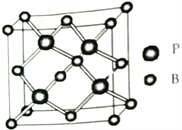
(5)磷化硼(BP)是一种耐磨材料,熔点高,其晶胞结构如图所示。该晶胞中B的堆积方式为___________,己知该晶体的晶胞参数a pm,用NA代表阿伏加德罗常数的值,则该晶体的密度为____ g·cm-3;构成晶体的两种粒子之间的最近距离为__________pm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学做元素性质递变规律实验时,设计了一套实验方案,记录了有关实验现象。
实验步骤 | 实验现象 |
① 将镁条用砂纸打磨后,放入试管中,加入少量水后,加热至水沸腾;再向溶液中滴加酚酞溶液 | A.浮在水面上,熔成小球,四处游动,发出“嘶嘶”声,随之消失,溶液变成红色 |
②将一小块金属钠放入滴有酚酞溶液的冷水中 | B.有气体产生,溶液变成浅红色 |
③将镁条投入稀盐酸中 | C.反应不十分剧烈;产生无色气体 |
④将铝条投入稀盐酸中 | D.剧烈反应,迅速产生大量无色气体 |
请帮助该同学整理并完成实验报告。
(1)实验目的:研究_________________元素性质递变规律。
(2)实验内容:(填写与实验步骤对应的实验现象的编号)
实验内容 | ① | ② | ③ | ④ |
实验现象(填A~D) | _________ | ______ | _______ | ___________ |
(3)写出实验①\②对应化学方程式
实验① ______________________________________________________________________,
实验②_______________________________________________________________________。
(4)实验结论:______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常见的太阳能电池有单晶硅太阳能电池、多晶硅太阳能电池、GaAs太阳能电池及铜铟镓硒薄膜太阳能电池等。
(1)Cu+在基态时的价电子排布式为__________________。
(2)砷、硒是第四周期的相邻元素,已知砷的第一电离能大于硒。请从原子结构的角度加以解释___________________________。
(3)GaAs熔点1238℃,难溶于溶剂。其晶体类型为_____________。
(4)AsF3的空间构型是:______________。
(5)硼酸(H3BO3)本身不能电离出H+,在水中易结合一个OH-生成[B(OH)4]-,而体现弱酸性。
①[B(OH)4]-中B原子的杂化类型为________。
②[B(OH)4]-的结构式为____________________。
(6)金刚石的晶胞如图,若以硅原子代替金刚石晶体中的碳原子,便得到晶体硅:若将金刚石晶体中一半的碳原子換成硅原子,且碳、硅原子交替,即得到碳化硅晶体(金刚砂)。

①金刚石、晶体硅、碳化硅的熔点由高到低的排列顺序是_______________________(用化学式表示)。
②立方氮化硼(BN)晶体的结构与金刚石相似,硬度与金刚石相当,立方氮化硼的密度是ρ g·㎝-3,,则晶胞边长为___________。(只要求列算式,不必计算出数值,阿伏伽徳罗常数为NA)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com