
【题目】莽草酸可用于合成药物达菲,其结构简式如图,下列关于莽草酸的说法正确的是( )
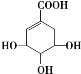
A.分子式为C7H10O5,属于芳香族化合物,易溶于水
B.分子中含有3种官能团,可以发生加成、氧化、取代等反应
C.在水溶液中,1mol莽草酸最多可电离出4molH+
D.1mol莽草酸与足量的NaHCO3溶液反应可放出4molCO2气体
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】如图是一稀酸对Fe﹣Cr合金随Cr含量变化的腐蚀性实验结果,下列有关说法正确的是( )

A.稀硝酸对Fe﹣Cr合金的腐蚀性比稀硫酸和稀盐酸的弱
B.稀硝酸和铁反应的化学方程式是:Fe+6HNO3(稀)═Fe(NO3)3+3NO2↑+3H2O
C.Cr含量大于13%时,因为三种酸中硫酸的氢离子浓度最大,所以对Fe﹣Cr合金的腐蚀性最强
D.随着Cr含量增加,稀硝酸对Fe﹣Cr合金的腐蚀性减弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知分解1mol H2O2放出热量98kJ,在含少量I-的溶液中,H2O2分解的机理为:
H2O2+I-→H2O+IO- 慢
H2O2+IO-→H2O+O2+I- 快
下列有关该反应的说法正确的是( )
A.反应速率与I-浓度无关
B.IO-也是该反应的催化剂
C.分解2mol H2O2放出热量196kJ
D.v(H2O2)=v(H2O)=v(O2)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】尼洛替尼用于治疗白血病有显著疗效。有机化合物M(![]() )是合成尼洛替尼的中间体,其一种合成路线如图:
)是合成尼洛替尼的中间体,其一种合成路线如图:

已知:含有α—氢的酯在醇钠等碱性缩合剂作用下发生缩合作用,失去一分子醇得到β—酮酸酯。如:
2CH3COOC2H5 CH3COCH2COOC2H5+C2H5OH
CH3COCH2COOC2H5+C2H5OH
回答下列问题:
(1)有机物A中含氧官能团的名称为___。
(2)M的分子中最多有___个碳原子在同一个平面上,M存在顺反异构现象,其反式异构体的结构简式是___。
(3)反应①的化学方程式为___;其反应类型为___。
(4)有机物![]() 有多种同分异构体,其中含有苯环的硝基化合物有___种,写出其中一种具有手性碳的同分异构体的结构简式为___。
有多种同分异构体,其中含有苯环的硝基化合物有___种,写出其中一种具有手性碳的同分异构体的结构简式为___。
(5)写出以乙醇、乙酸、 为原料合成
为原料合成 的合成路线(其它试剂任选)___。
的合成路线(其它试剂任选)___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,用0.1 mol·L-1NaOH溶液分别滴定20.00mL 0.1 mol·L-1的盐酸和醋酸,滴定曲线如图所示,下列说法正确的是
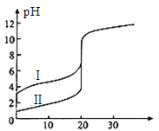
A.Ⅰ、Ⅱ分别表示盐酸和醋酸的滴定曲线
B.pH=7时,滴定盐酸和醋酸消耗NaOH溶液的体积相等
C.V(NaOH)=10.00mL时,醋酸溶液中c(CH3COO-)> c(Na+)> c(H+)> c(OH-)
D.V(NaOH)=20.00mL时,两溶液中c(CH3COO-)> c(Cl-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】足量铜与一定量的浓硝酸反应,得到硝酸铜溶液和NO2、NO的混合气体,这些气体与1.68L O2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸。若向所得硝酸铜溶液中加入6molL﹣1NaOH溶液至Cu2+恰好完全沉淀,则消耗NaOH溶液的体积是( )
A.60 mLB.45 mLC.30 mLD.50 mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:H2S:Ka1=1.3×10-7 Ka2=7.1×10-16 ,H2CO3:Ka1=4.3×10-7 Ka2=5.6×10-11, CH3COOH:Ka=1.8×10-5,HClO2:Ka=1.1×10-2,NH3·H2O:Kb=1.8×10-5。
(1)①常温下,0.1 mol·L-1Na2S溶液和0.1 mol·L-1Na2CO3溶液,碱性更强的是_____,其原因是_______。
②25 ℃时,CH3COONH4溶液显__性。NaHCO3溶液的pH___CH3COONa溶液的pH。
③NH4HCO3溶液显__性,原因是_________。
(2)能证明Na2SO3溶液中存在SO32-+H2OHSO3—+OH-水解平衡的事实是___。
A.滴入酚酞溶液变红,再加H2SO4溶液红色褪去
B.滴入酚酞溶液变红,再加BaCl2溶液后产生沉淀且红色褪去
C.滴入酚酞溶液变红,再加氯水后红色褪去
(3)25 ℃时,浓度均为0.1 mol·L-1的NaClO2溶液和CH3COONa溶液,两溶液中c(ClO2—)___c(CH3COO-)。若要使两溶液的pH相等应___。
a.向NaClO2溶液中加适量水 b.向NaClO2溶液中加适量NaOH
c.向CH3COONa溶液中加CH3COONa固体 d.向CH3COONa溶液中加适量的水
(4)在空气中直接加热CuCl2·2H2O晶体得不到纯的无水CuCl2,原因是_______(用化学方程式表示)。由CuCl2·2H2O晶体得到纯的无水CuCl2的合理方法是 ________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向![]() 溶液中滴加少量
溶液中滴加少量![]() 溶液,反应原理如图所示。关于该反应过程的说法正确的是
溶液,反应原理如图所示。关于该反应过程的说法正确的是

A.该反应过程中,![]() 是
是![]() 是
是![]() B.当有
B.当有![]() 生成时,转移
生成时,转移![]() 电子
电子
C.在![]() 分解过程中,溶液的
分解过程中,溶液的![]() 逐渐降低D.
逐渐降低D.![]() 的氧化性比
的氧化性比![]() 强,还原性比
强,还原性比![]() 弱
弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究NOx、COx的消除和再利用对改善生态环境、构建生态文明具有重要的意义。
Ⅰ.反应N2(g)+O2(g)=2NO(g)△H1=+180.5kJ·mol-1,汽车尾气中的NO(g)和CO(g)在一定条件下可发生反应2NO(g)+2CO(g)=N2(g)+2CO2(g)△H2。
(1)已知CO的燃烧热为283.0kJ·mol-1,则△H2=___。
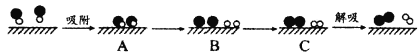
(2)某科研小组尝试利用固体表面催化工艺进行NO的分解。若用![]() 和
和![]() 分别表示O2、NO、N2和固体催化剂,在固体催化剂表面分解NO的过程如图所示。从吸附到解吸过程中的能量状态最低的是__(填字母序号)。
分别表示O2、NO、N2和固体催化剂,在固体催化剂表面分解NO的过程如图所示。从吸附到解吸过程中的能量状态最低的是__(填字母序号)。
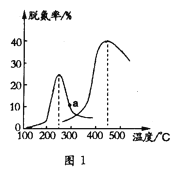
(3)另一研究小组探究催化剂对CO、NO转化的影响。将NO和CO以一定的流速通过两种不同的催化剂进行反应,相同时间内脱氮率(即NO的转化率)随温度的变化关系如图1所示。图中低于200℃,脱氮率随温度升高而变化不大的主要原因是___;a点(填“是”或“不是”)__对应温度下的平衡脱氮率,理由是__。
Ⅱ.向容积可变的密闭容器中充入1molCO和2.2molH2,在恒温恒压条件下发生反应CO(g)+2H2(g)CH3OH(g)△H<0,平衡时CO的转化率随温度、压强的变化情况如图2所示。
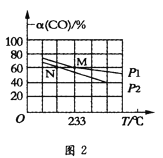
(4)反应速率:N点v正(CO)(填“大于”、“小于”或“等于”)__M点v逆(CO)。
(5)M点时,H2的转化率为__(计算结果精确到0.1%);用平衡分压代替平衡浓度计算该反应的平衡常数Kp=__(用含p1的最简表达式表达,分压=总压×物质的量分数)。
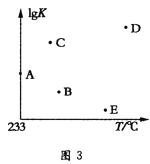
(6)不同温度下,该反应的平衡常数的对数值(lgK)如图3所示,则B、C、D、E四点中能正确表示该反应的lgK与温度(T)的关系的是___(填字母符号)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com