A、B、C、D、E五种溶液分别是NaOH、NH
3?H
2O、CH
3COOH、HCl、NH
4HSO
4中的一种.常温下进行下列实验:
①B、D均能与pH=3的A溶液反应,当它们以等物质的量混合时均能恰好反应,反应后得到的溶液前者呈酸性,后者呈中性;
②浓度均为0.1mol?L
-1C与D溶液等体积混合,溶液呈酸性.
回答下列问题:
(1)D是
NaOH
NaOH
,E是
CH3COOH
CH3COOH
;
(2)用水稀释0.1mol?L
-1B时,溶液中随着水量的增加而减小的是
a
a
(填写序号)
a.
b.
c.c(H
+)?c(OH
-) d.n(OH
-)
(3)pH相同的等体积的两份溶液A和E,分别与锌粉反应,若最后仅有一份溶液中存在锌粉,且放出氢气的质量相同,则下列说法正确的是
c
c
(填写序号)

a.反应所需要的时间E>A
b.开始反应时的速率A>E
c.参加反应的锌粉物质的量A=E
d.E溶液里有锌粉剩余
(4)将等体积、等物质的量浓度B和C混合后溶液,升高温度(溶质不会分解)溶液pH随温度变化如图中
④
④
曲线(填写序号).
(5)室温下,向0.01mol?L
-1C溶液中滴加0.01mol?L
-1D溶液至中性,得到的溶液中所有离子的物质的量浓度由大到小的顺序为
c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+)
c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+)
.

 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案 黄冈海淀全程培优测试卷系列答案
黄冈海淀全程培优测试卷系列答案
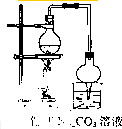 乙酸乙酯的实验室和工业制法常采用如下反应:
乙酸乙酯的实验室和工业制法常采用如下反应: