

 ,所以它属于二肽
,所以它属于二肽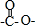 结构且能发生银镜反应 ②N原子直接与苯环相连③核磁共振氢谱有5种峰且峰面积比1:1:2:2:3,
结构且能发生银镜反应 ②N原子直接与苯环相连③核磁共振氢谱有5种峰且峰面积比1:1:2:2:3, ;
;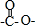 结构且能发生银镜反应,含有甲酸形成的酯基,②N原子直接与苯环相连,③核磁共振氢谱有5种峰且峰面积比1:1:2:2:3,则戊为
结构且能发生银镜反应,含有甲酸形成的酯基,②N原子直接与苯环相连,③核磁共振氢谱有5种峰且峰面积比1:1:2:2:3,则戊为 ,水解得到羧酸、酚羟基均与氢氧化钠反应.
,水解得到羧酸、酚羟基均与氢氧化钠反应. ,故答案为:
,故答案为: ;
;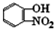 ,故答案为:
,故答案为: ;
; ,
, ,取代反应;
,取代反应;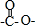 结构且能发生银镜反应,含有甲酸形成的酯基,②N原子直接与苯环相连,③核磁共振氢谱有5种峰且峰面积比1:1:2:2:3,则戊为
结构且能发生银镜反应,含有甲酸形成的酯基,②N原子直接与苯环相连,③核磁共振氢谱有5种峰且峰面积比1:1:2:2:3,则戊为 ,戊与NaOH溶液反应的化学方程式为:
,戊与NaOH溶液反应的化学方程式为: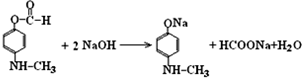 ,
, .
.


科目:高中化学 来源: 题型:
| A、物质的量浓度相等的Na2S和NaHS混合溶液中:c(Na+)+c(H+)=2c(S2-)+c(HS-)+c(OH-) |
| B、常温下将醋酸钠、盐酸两溶液混合后,溶液呈中性,则混合后溶液中:c(Na+)=c(CH3COO-)>c(OH-)=c(H+) |
| C、常温下c(NH4+)相等的①(NH4)2CO3、②(NH4)2SO4、③(NH4)2Fe(SO4)2三种溶液中,溶质的物质的量浓度大小:①>②>③ |
| D、等体积、等物质的量浓度的NaX和弱酸HX混合后呈酸性的溶液中:c(X-)>c(Na+)>c(HX)>c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A | ①完全燃烧后的产物中n(CO2):n(H2O)=2:1 ②28<Mr(A)<60 ③不能使溴的四氯化碳溶液褪色 ④一氯代物只有一种结构 ⑤碳碳之间都是单键 |
| B | ①饱和链烃,通常情况下呈气态 ②存在同分异构体 ③二溴代物有三种 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| T/℃ | 20 | 40 | 60 | 80 |
| S(Li2CO3)/g | 1.33 | 1.17 | 1.01 | 0.85 |
| S(Li2SO4)/g | 34.2 | 32.8 | 31.9 | 30.7 |
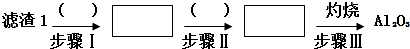
查看答案和解析>>
科目:高中化学 来源: 题型:
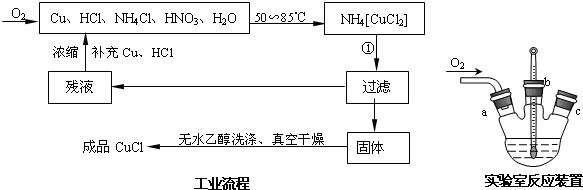

查看答案和解析>>
科目:高中化学 来源: 题型:
| 3 |
| 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 滴定次数 | 待测NaOH 溶液的体积来 | 0.1000mol/L盐酸的体积/mL[学+ | ||
| 滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
| 第一次 | 25.00 | 0.00 | 26.28 | 26.28 |
| 第二次 | 25.00 | 1.55 | 30.30 | 28.75 |
| 第三次 | 25.00 | 0.20 | 26.42 | 26.22 |
查看答案和解析>>
科目:高中化学 来源: 题型:
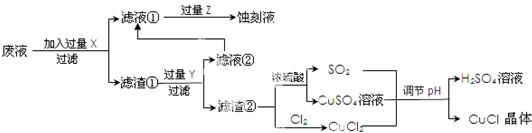
| 1 | 2 | 3 | |
| 0.25克样品消耗硫酸铈标准溶液的体积(ml) | 24.35 | 24.05 | 23.95 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、溶解→加适量BaCl2溶液→过滤 |
| B、溶解→加适量CaCl2溶液→过滤 |
| C、溶解→加适量Ca(OH)2溶液→过滤 |
| D、溶解→加适量盐酸→加热 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com