
| A. | 2.8g | B. | 3.36g | C. | 4.2g | D. | 5.6g |
分析 根据酸的物质的量关系和生成氢气的体积比可判断出盐酸不足,硫酸过量,根据盐酸与铁反应生成氢气的体积可计算铁与硫酸反应生成氢气的体积,以此计算铁的质量.
解答 解:由题意可知:n(HCl)=n(H2SO4)=0.1L×1mol/L=0.1mol,
两种酸溶液中H+物质的量比值为1:2,
当铁完全反应时,生成氢气的体积比为1:1,当酸完全反应时,生成氢气的体积为1:2,
往两个烧杯中分别加入等质量的铁粉,充分反应后生成氢气的体积比为2:3,介于1:1和1:2之间,
则说明盐酸不足,硫酸过量,
Fe+2HCl=FeCl2+H2↑
2 1
0.1mol 0.05mol
则铁与硫酸反应生成氢气的物质的量为0.075mol,
Fe+H2SO4=FeSO4+H2↑
1 1
n(Fe) 0.075mol
n(Fe)=0.075mol,
m(Fe)=0.075mol×56g/mol=4.2g.
故选C.
点评 本题考查方程式的相关计算,题目难度不大,注意根据反应的气体的体积关系判断两种酸反应的程度为解答该题的关键.


 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案科目:高中化学 来源: 题型:解答题

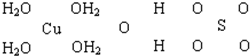
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 某有机物如图所示,该有机物不可能发生的化学反应是( )
某有机物如图所示,该有机物不可能发生的化学反应是( )| A. | ①④ | B. | ⑦ | C. | ②⑤ | D. | ②⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| T/℃ | 700 | 800 | 900 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
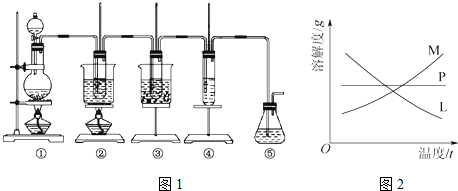
| 实验现象 | 原因 |
| 溶液逐渐变为红色 | 氯气与水反应生成的H+使石蕊变色 |
| 随后溶液逐渐变为无色 | 氯气与水反应生成的HClO将石蕊氧化为无色物质 |
| 然后溶液从无色逐渐变为黄绿色 | 继续通入的氯气溶于水使溶液呈黄绿色 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 在如图用石墨作电极的电解池中,放入500mL含一种溶质的某蓝色溶液(pH=4)进行电解,观察到A电极表面有红色的固态物质生成,B电极有无色气体生成;当溶液中的原有溶质完全电解后,停止电解,取出A电极,洗涤、干燥、称量、电极增重1.6g.请回答下列问题:
在如图用石墨作电极的电解池中,放入500mL含一种溶质的某蓝色溶液(pH=4)进行电解,观察到A电极表面有红色的固态物质生成,B电极有无色气体生成;当溶液中的原有溶质完全电解后,停止电解,取出A电极,洗涤、干燥、称量、电极增重1.6g.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石膏能使豆浆变成豆腐 | |
| B. | 明矾净水 | |
| C. | 花粉在水面上做布朗运动 | |
| D. | 太阳光照在弥漫灰尘的室内,可看到从窗口到地面出现一条光亮的通路 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含1molNa2S的溶液,最多可吸收2molSO2 | |
| B. | 可以用浓硫酸除去镀在铝表面的铜镀层 | |
| C. | Li、C、S分别在足量氧气中燃烧均生成一种相应氧化物 | |
| D. | NaHCO3、Na2CO3、(NH4)2CO3三种固体受热后均能生成气体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com