
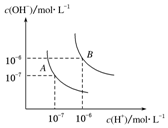
 水的电离平衡曲线如图所示,若A点表示25℃时水的电离达平衡时的离子浓度,B点表示100℃时水的电离达平衡时的离子浓度.则100℃时1mol•L-1的NaOH溶液中,由水电离出的c(H+)=1×10-12mol•L-1,KW(25℃)<KW(100℃)(填“>”、“<”或“=”).
水的电离平衡曲线如图所示,若A点表示25℃时水的电离达平衡时的离子浓度,B点表示100℃时水的电离达平衡时的离子浓度.则100℃时1mol•L-1的NaOH溶液中,由水电离出的c(H+)=1×10-12mol•L-1,KW(25℃)<KW(100℃)(填“>”、“<”或“=”). 分析 Kw=c(H+)•c(OH-),氢氧化钠溶液中由水电离出的c(H+)=溶液中c(OH-),温度不同,Kw不同,升温促进水的电离,氢离子浓度增大.
解答 解:25℃时纯水中c(H+)=c(OH-)=10-7 mol/L,Kw=c(H+)•c(OH-)=10-14 ,当温度升高到100℃,纯水中c(H+)=c(OH-)=10-6 mol/L,Kw=c(H+)•c(OH-)=10-12 ;100℃时1mol•L-1 的NaOH溶液中Kw=c(H+)•c(OH-)=10-12 ;c(OH-)=1mol/L,水电离出的c(H+)=1×10-12mol/L,
水的电离时吸热过程,加热促进电离氢离子浓度和氢氧根离子浓度增大,Kw增大,所以Kw(25℃)<Kw(100℃),
故答案为:1×10-12;<.
点评 本题考离子积常数、水的电离的影响因素,题目难度不大,明确溶液的构成、Kw和水的电离的影响因素是关键.


 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案科目:高中化学 来源: 题型:解答题
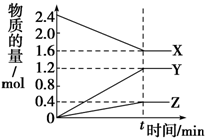 在2L容器中有3种物质进行反应,X、Y、Z的物质的量随时间的变化曲线如图所示,反应在t时刻达到平衡.
在2L容器中有3种物质进行反应,X、Y、Z的物质的量随时间的变化曲线如图所示,反应在t时刻达到平衡.| A | B | C | |
| 反应开始时浓度(mol/L) | 4.8 | 0 | |
| 2min后的浓度(mol/L) | 1.2 | 0.8 | |
| 2min内的浓度的变化(mol/L) | 0.4 | ||
| 化学学反应速率[mol/(L•min)] | 0.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
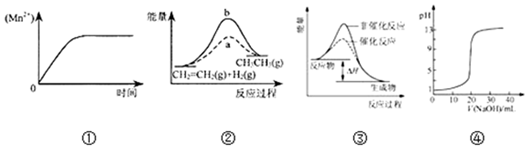
| A. | 图①表示10 mL 0.01 mol•L-1 KMnO4 酸性溶液与过量的0.1 mol•L-1 H2C2O4溶液混 合时,n(Mn2+) 随时间的变化 | |
| B. | 图②中a、b曲线分别表示反应CH2=CH2 (g)+H2(g)→CH3CH3(g);△H<0使用和未使用催化剂时,反应过程中的能量变化 | |
| C. | 图③表示某放热反应分别在有、无催化剂的情况下反应过程中的能量变化 | |
| D. | 图④表示0.1000mol•L-1NaOH溶液滴定20.00mL0.1000mol•L-1CH3COOH溶液所得到的滴定曲线 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{1}{44}$ mol-1 | B. | $\frac{x}{22}$ mol-1 | C. | $\frac{3x}{44}$ mol-1 | D. | $\frac{44x}{3}$ mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 增大压强,化学平衡不一定移动 | |
| B. | 通入氦气,化学平衡一定不发生移动 | |
| C. | 增加X或Y的物质的量,化学平衡一定发生移动 | |
| D. | 其它条件不变,升高温度,化学平衡一定发生移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 周期表前四周期的元素A、B、C、D、E,原子序数依次增大.A的核外电子总数与其周期数相同,B的价电子层中未成对电子有3个,C的最外层电子数为其内层电子数的3倍,D与C同族;E的最外层只有1个电子,但次外层有18个电子.回答下列问题;
周期表前四周期的元素A、B、C、D、E,原子序数依次增大.A的核外电子总数与其周期数相同,B的价电子层中未成对电子有3个,C的最外层电子数为其内层电子数的3倍,D与C同族;E的最外层只有1个电子,但次外层有18个电子.回答下列问题;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
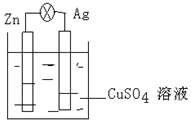 (1)在银锌原电池中,以硫酸铜为电解质溶液,锌为负极,该电极上发生的电极反应式为Zn-2e-=Zn2+,银电极上发生的是还原反应(“氧化”或“还原”).
(1)在银锌原电池中,以硫酸铜为电解质溶液,锌为负极,该电极上发生的电极反应式为Zn-2e-=Zn2+,银电极上发生的是还原反应(“氧化”或“还原”). .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com