
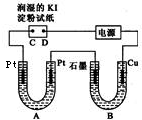
 电解装置如图所示,图中B装置盛有1L2mol•L-1的Na2SO4溶液,A装置盛有1L2mol•L-1的AgNO3溶液,通电后,湿润的淀粉KI试纸的C端变蓝色,电解一段时间后,试回答:
电解装置如图所示,图中B装置盛有1L2mol•L-1的Na2SO4溶液,A装置盛有1L2mol•L-1的AgNO3溶液,通电后,湿润的淀粉KI试纸的C端变蓝色,电解一段时间后,试回答:分析 (1)B中盛有饱和Na2SO4溶液通电一会儿,发现湿润的淀粉KI试纸的C端变为蓝色,说明生成碘,发生氧化反应,则C为阳极,D为阴极E为负极,F为正极;A为电解AgNO3溶液,阴极生成Ag,阳极生成氧气;
(2)B中盛有饱和Na2SO4溶液,Cu为阳极,阳极生成铜离子,阴极生成氢气,溶液生成氢氧化铜沉淀;
(3)A、B装置中共收集到标准状况下的气体0.168L,应分别为氧气和氢气,则氧气为0.168L,计算氧气的物质的量并计算电子转移的情况据此计算pH.
解答 解:(1)B中盛有饱和Na2SO4溶液通电一会儿,发现湿润的淀粉KI试纸的C端变为蓝色,说明生成碘,发生氧化反应,则C为阳极,D为阴极E为负极,F为正极,
A为电解AgNO3溶液,阴极生成Ag,阳极生成氧气,方程式为4AgNO3+2H2O$\frac{\underline{\;通电\;}}{\;}$4Ag+O2↑+4HNO3,
故答案为:4AgNO3+2H2O$\frac{\underline{\;通电\;}}{\;}$4Ag+O2↑+4HNO3;
(2)B中盛有饱和Na2SO4溶液,Cu为阳极,阳极生成铜离子,Cu极周围变蓝色,阴极生成氢气,溶液生成氢氧化铜沉淀,
故答案为:Cu棒周围开始时变蓝色,石墨上有气泡产生,一段时间后,U形管B的底部有沉淀;
(3)A、B装置中共收集到标准状况下的气体0.168L,应分别为氧气和氢气,则氧气为0.168L×$\frac{1}{3}$=0.056L,n(02)=$\frac{0.056L}{22.4L/mol}$=0.0025mol,转移电子0.01mol,A中盛有AgNO3溶液,电解时生成硝酸,n(H+)=n(e-)=0.01mol,则c(H+)=$\frac{0.01mol}{1L}$=0.01mol/L,则pH=2,
故答案为:2.
点评 本题综合考查电解原理,侧重于考查学生综合运用电解知识的能力,题目难度较大,注意把握电解规律,能正确判断电极方程式.


 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源: 题型:选择题
 ),下列说法不正确的是( )
),下列说法不正确的是( )| A. | 它的一氯代物只有一种同分异构体,其二氯代物有两种同分异构体 | |
| B. | 分子中存在极性键、非极性键 | |
| C. | 它不是芳香烃,但与苯乙烯互为同分异构体 | |
| D. | 它含碳质量分数与乙炔、苯等物质相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 遇氯化氢产生白烟 | B. | 能使湿润的蓝色石蕊试纸变红 | ||
| C. | 刺激性气味、密度比空气小 | D. | 其水溶液能使酚酞溶液变红 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com