
| A. | △H1=-178.32kJ•mol-1△H2=+78.3kJ•mol-1 | |
| B. | △H1=+178.32kJ•mol-1△H2=-78.3kJ•mol-1 | |
| C. | △H1=-178.32kJ•mol-1△H2=+78.3kJ•mol-1 | |
| D. | △H1=+178.32kJ•mol-1△H2=+78.3kJ•mol-1 |
分析 根据碳酸钙分解CaCO3(s)═CaO(s)+CO2(g)△H1仅在高温下自发进行,固体分解得到气体,混乱度增加,△S>0,根据△G=△H-T•△S<0自发判断△H1;
氯酸钾的分解2KClO3(s)=2KCl(s)+3O2↑(g)△H2在任何温度下都自发进行,固体分解得到气体,混乱度增加,△S>0,根据△G=△H-T•△S<0自发判断△H2.
解答 解:根据碳酸钙分解CaCO3(s)═CaO(s)+CO2(g)△H1仅在高温下自发进行,又固体分解得到气体,混乱度增加,△S>0,根据△G=△H-T•△S<0自发,所以△H1必定>0;
而氯酸钾的分解2KClO3(s)=2KCl(s)+3O2↑(g)△H2在任何温度下都自发进行,固体分解得到气体,混乱度增加,△S>0,根据△G=△H-T•△S<0自发,所以△H2必定<0;
故选:B.
点评 本题考查化学反应进行的方向,能够根据化学方程式准确判断出熵变,然后根据△G=△H-T•△S<0自发判断温度即可.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单位时间内生成2n mol X,同时消耗nmol Y | |
| B. | X的生成速率与Z的生成速率相等 | |
| C. | X、Y、Z的浓度相等 | |
| D. | 容器内气体的压强不再变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
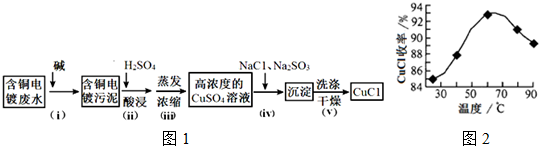
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al-Al2O3-Al(OH)3-NaAlO2 | B. | S-SO3-H2SO4-MgSO4 | ||
| C. | Mg-MgCl2-Mg(OH)2-MgO | D. | Si-SiO2-H2SiO3-Na2 SiO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
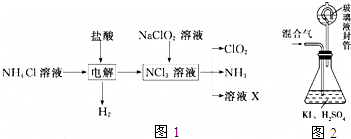
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com