
【题目】充分利用碳的氧化物合成化工原料,既可以减少环境污染和温室效应,又能变废为宝。
Ⅰ.CO2的综合利用是解决温室效应及能源问题的有效途径。
(1)O2和H2在催化剂存在下可发生反应生成CH3OH。已知CH3OH、H2的燃烧热分别为△H1=-akJ·mol-1、△H2=-bkJ·mol-1,且1mol水蒸气转化为液态水时放出ckJ的热量。
则CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)△H=___________kJ·mol-1。
CH3OH(g)+H2O(g)△H=___________kJ·mol-1。
(2)对于CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g).控制CO2和H2初始投料比为1∶3时,温度对CO2平衡转化率及甲醇产率的影响如图所示。由图可知获取CH3OH最适宜的温度是___________,下列有利于提高CO2转化为CH3OH的平衡转化率的措施是___________。
CH3OH(g)+H2O(g).控制CO2和H2初始投料比为1∶3时,温度对CO2平衡转化率及甲醇产率的影响如图所示。由图可知获取CH3OH最适宜的温度是___________,下列有利于提高CO2转化为CH3OH的平衡转化率的措施是___________。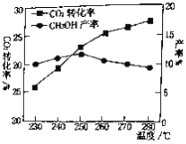
A.使用催化剂 B.增大体系压强
C.增大CO2和H2的初始投料比 D.投料比不变和容器体积不变,增加反应物的浓度
Ⅱ.CO是合成尿素、甲酸的原料。
(3)合成尿素的反应:2NH3(g)+CO(g)![]() CO(NH2)2(g)+H2(g)△H=-81.0kJ·mol-1。
CO(NH2)2(g)+H2(g)△H=-81.0kJ·mol-1。
①T℃时,在体积为2L的恒容密闭容器中,将2molNH3和1molCO混合发生反应,5min时,NH3的转化率为80%。则0~5min内的平均反应速率为v(CO)=___________。
②已知:
温度/K | 398 | 498 | … |
平衡常数/K | 126.5 | K1 | … |
则:K1___________126.5(填“>”或“<”);其判断理由是___________。
(4)通过人工光合作用可将CO转化成HCOOH。
①已知常温下,浓度均为0.1mol·L-1的HCOOH和HCOONa混合溶液pH=3.7,则HCOOH的电离常数Ka的值为___________ (已知lg2=0.3)。
②用电化学可消除HCOOH对水质造成的污染,其原理是电解CoSO4、稀硫酸和HCOOH混合溶液,用电解产生的Co3+将HCOOH氧化成CO2。Co3+氧化HCOOH的离子方程式为___________;忽略体积变化,电解前后Co2+的浓度将___________ (填“增大”“减小”或“不变”)。
【答案】 a-3b+c 250℃ BD 0.08mol·L-1·min-1 < 合成尿素的反应为放热反应,温度升高,平衡逆向移动,K减小 2×10-4 2Co3++HCOOH=CO2↑+2Co2++2H+ 不变
【解析】 (1)已知CH3OH、H2的燃烧热分别为△H1=-akJ·mol-1、△H2=-bkJ·mol-1,且1mol水蒸气转化为液态水时放出ckJ的热量。则①CH3OH(g)+O2(g) CO2(g)+2H2O(l)△H1=-akJ/mol,②H2(g) +![]() O2(g)=H2O(l)△H=-bkJ/mol,③H2O(g)= H2O(l) △H=-ckJ/mol,根据盖斯定律,将②×3-①-③得:CO2(g)+3H2(g)
O2(g)=H2O(l)△H=-bkJ/mol,③H2O(g)= H2O(l) △H=-ckJ/mol,根据盖斯定律,将②×3-①-③得:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)△H= (a-3b+c)kJ/mol,故答案为:a-3b+c;
CH3OH(g)+H2O(g)△H= (a-3b+c)kJ/mol,故答案为:a-3b+c;
(2)根据图像,在250℃时,甲醇的产率较高,获取CH3OH最适宜的温度是250℃;A.使用催化剂,平衡不移动,不能提高CO2转化为CH3OH的平衡转化率,错误;B.增大体系压强,平衡正向移动,有利于提高CO2转化为CH3OH的平衡转化率,正确;C.增大CO2和H2的初始投料比,可以提高氢气的转化率,但二氧化碳的转化率减小,错误;D.投料比不变和容器体积不变,增加反应物的浓度,平衡正向移动,可以提高CO2转化为CH3OH的平衡转化率,正确;故选BD,故答案为:250℃;BD;
(3)①5min时,NH3的转化率为80%,则0-5min时,NH3的转化量为△c=![]() =0.8mol/L,则NH3的消耗速率为v(NH3)=
=0.8mol/L,则NH3的消耗速率为v(NH3)=![]() =
=![]() =0.16mol/(Lmin),根据化学反应速率之比等于化学计量数之比,则CO的消耗速率为v(CO)=
=0.16mol/(Lmin),根据化学反应速率之比等于化学计量数之比,则CO的消耗速率为v(CO)=![]() v(NH3)=0.08mol/(Lmin),故答案为:0.08mol/(Lmin);
v(NH3)=0.08mol/(Lmin),故答案为:0.08mol/(Lmin);
②反应为放热反应,温度升高不利于反应正向进行,正反应进行程度随温度的升高而降低,所以K1<126.5,判断理由是:合成尿素的反应为放热反应,温度升高,平衡逆移,K减小,故答案为:<;合成尿素的反应为放热反应,温度升高,平衡逆移,K减小;
(4)①浓度均为0.1mol/L的HCOOH和HCOONa混合溶液pH=3.7,溶液中平衡时c(HCOOH)=c(HCOO-),c(H+)=10-3.7mol/L,所以HCOOH的电离常数Ka= =10-3.7=2×10-4,故答案为:2×10-4;
=10-3.7=2×10-4,故答案为:2×10-4;
②用电化学可消除HCOOH对水质造成的污染的原理为电解CoSO4、稀硫酸和HCOOH的混合溶液,将Co2+氧化为Co3+,Co3+再将HCOOH氧化成CO2,电解池中该电极上发生失电子的氧化反应,电极反应为:Co2+-e-═Co3+,Co3+氧化HCOOH生成二氧化碳,反应的离子方程式为2Co3++HCOOH=CO2↑+2Co2++2H+,忽略体积变化,电解前后Co2+的浓度不发生变化,故答案为:2Co3++HCOOH=CO2↑+2Co2++2H+;不变。


 计算高手系列答案
计算高手系列答案科目:高中化学 来源: 题型:
【题目】下列有关图的分析中,不正确的是( )

A. 如果该图为组成活细胞中的元素,则A是氧元素
B. 如果该图表示的菠菜叶肉细胞中的元素,则其中Mo的含量很少
C. 如果该图表示的是组成骨骼肌细胞的化合物,则A是蛋白质
D. 如果该图为组成大豆细胞的有机物,则A肯定含有的元素是C、H、0、N
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图所示,其中W原子的质子数是其M层电子数的三倍,下列说法不正确的是( )

A. X与Y可形成5种以上的化合物
B. 工业上常通过电解Z的熔融氯化物的方法来制取Z的单质
C. 简单离子的半径由大到小为:Q>X>Y>Z
D. X、W、Q最高价氧化物对应水化物的酸性Q>X>W
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知t ℃时AgCl的Ksp=4×10-10,在t ℃时,Ag2CrO4在水中的沉淀溶解平衡曲线如图所示。下列说法错误的是( )
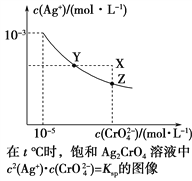
A. 在t ℃时,Ag2CrO4的Ksp为1×10-11
B. 在饱和溶液中加入K2CrO4(s)可使溶液由Y点到Z点
C. 在t ℃,Ag2CrO4(s)+2Cl-(aq) ![]() 2AgCl(s)+CrO
2AgCl(s)+CrO![]() (aq)平衡常数K=6.25×107
(aq)平衡常数K=6.25×107
D. 在t ℃时,以0.001 mol·L-1 AgNO3溶液滴定20 mL 0.001 mol·L-1 KCl和0.001 mol·L-1的K2CrO4的混合溶液,CrO![]() 先沉淀
先沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关从海带中提取碘的实验原理和装置能达到实验目的的是

A. 用装置甲灼烧碎海带
B. 用装置乙过滤海带灰的浸泡液
C. 用装置丙制备用于氧化浸泡液中I的Cl2
D. 用装置丁吸收氧化浸泡液中I后的Cl2尾气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于化学键的下列叙述中,正确的是
A.共价键一定存在于共价化合物中B.共价化合物可能含离子键
C.离子化合物中只含离子键D.共价化合物中一定不含离子键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙二胺(H2NCH2CH2NH2),无色液体,有类似氨的性质。已知:25℃时,Kb1=10-4.07Kb2=10-7.15;乙二胺溶液中各含氮微粒的分布分数δ(平衡时某含氮微粒的浓度占各含氮微粒浓度之和的分数)随溶液pH的变化曲线如右图。下列说法错误的是

A. H2NCH2CH2NH2在水溶液中第一步电离的方程式为:H2NCH2CH2NH2+H2O![]() H2NCH2CH2NH3++OH-
H2NCH2CH2NH3++OH-
B. 曲线Ⅰ代表的微粒符号为[H3NCH2CH2NH3]2+
C. 曲线Ⅰ与曲线Ⅱ相交点对应pH=4.07
D. 在0.1mol·L-1 H2NCH2CH2NH3Cl溶液中各离子浓度大小关系为c(Cl-)>(H2NCH2CH2NH3+) >c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醋酸亚铬水合物的化学式为[Cr(CH3COO)2]2·2H2O,该水合物通常为红棕色晶体,是一种常用的氧气吸收剂,不溶于水和乙醚(一种易挥发的有机溶剂),微溶于乙醇,易溶于盐酸,易被氧化。已知Cr3+水溶液呈绿色,Cr2+水溶液呈蓝色。实验室制备醋酸亚铬水合物的装置如下图所示。

(1)检查装置气密性后,向左侧三颈烧瓶中依次加入过量锌粒和适量CrCl3溶液,关闭K1打开K2,旋开a的旋塞,控制好滴速。a的名称是___________,此时左侧三颈烧瓶中发生反应的化学方程式为_______、________。一段时间后,整个装置内充满氢气,将空气排出。当观察到左侧三颈烧瓶中溶液颜色由绿色完全转变为蓝色时,关闭K2,打开K1,将左侧三颈烧瓶内生成的CrCl2溶液压入右侧三颈烧瓶中,则右侧三颈烧瓶中发生反应的离子方程式为________________________________________。
(2)本实验中所有配制溶液的水均需煮沸,其原因是______________________。右侧的烧怀内盛有水,其中水的作用是_______________________________________________。
(3)当观察到右侧三颈烧瓶内出现大量红棕色晶体时,关闭a 的旋塞。将红棕色晶体快速过滤、水洗、乙醚洗、干燥,即得到[Cr(CH3COO)2]2·2H2O。其中用乙醚洗涤产物的目的是_______________________。
(4)称量得到的[Cr(CH3COO)2]2·2H2O晶体,质量为m g,,若所取用的CrCl3溶液中含溶质n g,则[Cr(CH3COO)2]2·2H2O(M1=376 )的产率是______%。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com