
 某研究性学习小组为合成1-丁醇,查阅资料得知一条合成路线:CH2CH=CH2+CO+H2$→_{△}^{催化剂}$CH3CH3CH2CHO$→_{△}^{H_{2}催化剂}$CH3CH2CH2CH2OH.
某研究性学习小组为合成1-丁醇,查阅资料得知一条合成路线:CH2CH=CH2+CO+H2$→_{△}^{催化剂}$CH3CH3CH2CHO$→_{△}^{H_{2}催化剂}$CH3CH2CH2CH2OH.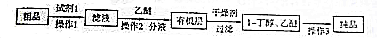
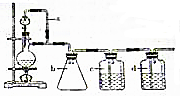
分析 (1)甲酸在浓硫酸的作用下通过加热脱水生成CO,由于甲酸易挥发,产生的CO中必然会混有甲酸,所以在收集之前需要除去甲酸,可以利用NaOH溶液吸收甲酸.甲酸易溶于水,所以必需防止液体倒流,即b的作用是防止倒吸,最后通过浓硫酸干燥CO.为了使产生的气体能顺利的从发生装置中排出,就必需保持压强一致,因此a的作用是保持恒压,CO直接排放会污染空气,最终需要进行尾气处理;
(2)用上述装置制取丙烯,需要用温度计控制温度;
检验丙烯可以用酸性KMnO4溶液或溴水,SO2也能与酸性KMnO4溶液褪色、溴水反应,应向用氢氧化钠溶液除去,再利用品红溶液检验SO2是否除尽;
(3)粗品中含有正丁醛,根据所给的信息,利用饱和NaHSO3溶液形成沉淀,然后通过过滤即可除去;由于饱和NaHSO3溶液是过量的,所以加入乙醚的目的是萃取溶液中的1-丁醇,经过分液操作与NaHSO3溶液分离,因为1-丁醇和乙醚的沸点相差很大,因此可以利用蒸馏将其分离开;
正丁醛含有醛基,利用氢氧化铜悬浊液或银氨溶液检验;
(4)将每一步的利用率或损失率都转化为起始原料的利用率或损失率,据此计算原料的实际利用率,产品的产率等于起始原料的实际利用率.
解答 解:(1)甲酸在浓硫酸的作用下通过加热脱水即生成CO,由于甲酸易挥发,产生的CO中必然会混有甲酸,所以在收集之前需要除去甲酸,可以利用NaOH溶液吸收甲酸.甲酸易溶于水,所以必需防止液体倒流,即b的作用是防止倒吸,最后通过浓硫酸干燥CO.为了使产生的气体能顺利的从发生装置中排出,就必需保持压强一致,因此a的作用是保持恒压;
CO直接排放会污染空气,最终需要进行尾气处理,上述装置存在的一处明显不足是:缺少尾气处理装置,
故答案为:保持恒压;防倒吸; NaOH溶液;浓硫酸;缺少尾气处理装置;
(2)用上述装置制取丙烯,需要用温度计控制温度;
检验丙烯可以用酸性KMnO4溶液或溴水,SO2也能与酸性KMnO4溶液褪色、溴水反应,应向用氢氧化钠溶液除去,再利用品红溶液检验SO2是否除尽,
故答案为:温度计;氢氧化钠溶液;品红溶液;
(3)粗品中含有正丁醛,根据所给的信息,利用饱和NaHSO3溶液形成沉淀,然后通过过滤即可除去;由于饱和NaHSO3溶液是过量的,所以加入乙醚的目的是萃取溶液中的1-丁醇,经过分液操作与NaHSO3溶液分离,因为1-丁醇和乙醚的沸点相差很大,因此可以利用蒸馏将其分离开;
正丁醛含有醛基,利用氢氧化铜悬浊液或银氨溶液检验,
故答案为:饱和NaHSO3溶液;过滤;萃取;蒸馏;氢氧化铜悬浊液或银氨溶液;
(4)将每一步的利用率或损失率都转化为起始原料的利用率或损失率,则原料的实际利用率为85%×78.5%×(1-1.5%),产品的产率等于起始原料的实际利用率,即产品产率为85%×78.5%×(1-1.5%),
故答案为:85%×78.5%×(1-1.5%).
点评 本题考查有机物合成方案、物质的检验、物质的分离提纯、对装置的分析评价、有损失率的多步反应计算等,题目综合性较大,明确原理是解题关键,是对学生综合能力的考查,难度中等.


科目:高中化学 来源: 题型:填空题
 原子序数由小到大排列的四种短周期元素X、Y、Z、W四种元素的原子序数之和为34,在周期表中X是原子半径最小的元素,Y、Z左右相邻,Y、W位于同主族.
原子序数由小到大排列的四种短周期元素X、Y、Z、W四种元素的原子序数之和为34,在周期表中X是原子半径最小的元素,Y、Z左右相邻,Y、W位于同主族.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ②③①④ | C. | ④①③② | D. | ③④①② |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 熔沸点:H2O>HF>HCl | B. | 原子半径:Mg>Na>O | ||
| C. | 酸性:H3PO4>H2SO4>HClO4 | D. | 热稳定性:H2O>HF>H2S |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 CuCl是应用广泛的有机合成催化剂,可采取不同方法制取.
CuCl是应用广泛的有机合成催化剂,可采取不同方法制取. [CuCl3]2-(无色溶液)逆向移动,生成CuCl.
[CuCl3]2-(无色溶液)逆向移动,生成CuCl.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 阳 | Fe | Mg | Al | Cr |
| 开始沉淀时的H | 1.9 | 9.0 | -- | -- |
| 沉淀完全时的H | 3. | 11.1 | 8 | 9 (>9溶解) |
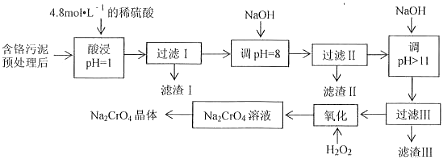
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
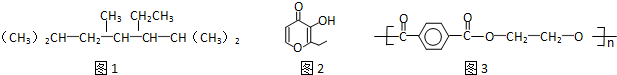
| A. | 按系统命名法命名时,(图1)化合物的名称是2,4,6-三甲基-3-乙基庚烷 | |
| B. | 有机物(图2)的一种芳香族同分异构体能发生银镜反应 | |
| C. | 高分子化合物(图3),其单体为对苯二甲酸和乙醇 | |
| D. | 前期在西非国家爆发的埃博拉疫情极具蔓延之势,已知该病毒对化学药品敏感.乙醇、次氯酸钠溶液均可以将病毒氧化而达到消毒的目的 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 金属钠与水反应:Na+H2O═Na++OH-+H2↑ | |
| B. | 铜粉溶于氯化铁溶液中:Cu+2Fe3+═2Fe2++Cu2+ | |
| C. | 氯气与冷氢氧化钠溶液反应:Cl2+2OH-═Cl-+ClO-+H2O | |
| D. | 向氯化铝溶液中加入过量氨水:4OH-+Al3+═AlO2-+2H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com