
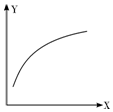
 在密闭容器中通入A、B两种气体,在一定条件下反应:2A(g)+B(g)?2C(g)△H<0.达到平衡后,改变一个条件(X),下列量(Y)的变化一定符合图中曲线的是( )
在密闭容器中通入A、B两种气体,在一定条件下反应:2A(g)+B(g)?2C(g)△H<0.达到平衡后,改变一个条件(X),下列量(Y)的变化一定符合图中曲线的是( )| X | Y | |
| A | 再加入A | B的转化率 |
| B | 再加入C | A的体积分数 |
| C | 减小压强 | A的转化率 |
| D | 升高温度 | 混合气体平均摩尔质量 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.加A促进B的转化,平衡正向移动;
B.体积不变时,再加入C,压强增大,平衡正向移动;
C.该反应为气体体积减小的反应,则减小压强,平衡逆向移动;
D.该反应为放热反应,升高温度,平衡逆向移动.
解答 解:A.加A促进B的转化,平衡正向移动,则随A的加入,B的转化率增大,与图象一致,故A正确;
B.体积不变时,再加入C,压强增大,平衡正向移动,则A的体积分数减小,故B错误;
C.该反应为气体体积减小的反应,则减小压强,平衡逆向移动,则A的转化率减小,故C错误;
D.该反应为放热反应,升高温度,平衡逆向移动,由M=$\frac{m}{n}$可知,混合气体平均摩尔质量减小,故D错误;
故选A.
点评 本题考查化学平衡的影响因素,为高频考点,把握温度、浓度、压强对平衡移动的影响为解答的关键,侧重分析与应用能力的考查,注意图中随X的增大导致Y增大,题目难度不大.


科目:高中化学 来源: 题型:实验题
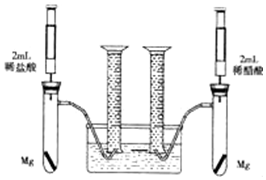 某化学小组为比较盐酸和醋酸的酸性强弱,设计了如下实验方案.装置如图(夹持仪器略)
某化学小组为比较盐酸和醋酸的酸性强弱,设计了如下实验方案.装置如图(夹持仪器略)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入2molNH3反应达平衡时共吸收92.4kJ的热量 | |
| B. | 若转移1.5mol电子,则消耗0.75mol的H2 | |
| C. | 当V正(N2)=3V逆(H2)时,反应达到平衡 | |
| D. | 当反应达到平衡时,增大压强,V逆减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲基橙呈红色的溶液中:S2O32-、Al3+、C2O42-、SO42- | |
| B. | Kw/c(H+ )=0.1mol•L-1的溶液:K+、Na+、CO32-、NO3- | |
| C. | 0.1mol•L-1 AgNO3溶液:H+、K+、SO42-、I- | |
| D. | 无色溶液中:Cr2O72-、NH4+、Cl-、S2- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某溶液中加入盐酸能产生使澄清石灰水变浑浊的气体,该溶液一定有CO32- | |
| B. | 为测定熔融氢氧化钠的导电性,可在瓷坩埚中熔化氢氧化钠固体后进行测量 | |
| C. | 除去铁粉中混有的少量铝粉,可加入过量的氢氧化钠溶液,完全反应后过滤 | |
| D. | 制备Fe(OH)3胶体,通常是将Fe(OH)3固体溶于热水中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | W的氢化物比X的氢化物稳定 | |
| B. | Y在周期表中的位置为第3周期、IB族 | |
| C. | Z的最高价氧化物对应的水化物的碱性比Y的弱 | |
| D. | X的单质与含W化合物不可能发生置换反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2O2溶于水 | B. | Ba(OH)2•8H2O与NH4Cl(s)混合并搅拌 | ||
| C. | 灼热的炭与CO2反应 | D. | 铝热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
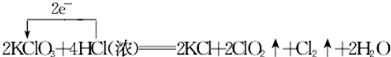 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com