
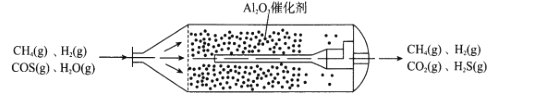
【题目】羰基硫(COS)主要存在于煤、石油和天然气中,会造成设备腐蚀、环境污染,更危害人体健康。目前,我国已经实现了在催化剂(γ-Al2O3)、低温条件下的精度脱除COS,如图为天然气中脱除COS反应流化床示意图:
(1)①已知:H2(g)+COS(g)![]() H2S(g)+CO(g) △H1=+6.2kJmol-1
H2S(g)+CO(g) △H1=+6.2kJmol-1
H2(g)+CO2(g)![]() H2O(g)+CO(g) △H2=+41.2kJmol-1
H2O(g)+CO(g) △H2=+41.2kJmol-1
则COS精度脱除反应H2O(g)+COS(g)![]() H2S(g)+CO2(g)的△H=__kJmol-1。
H2S(g)+CO2(g)的△H=__kJmol-1。
②将H2O与COS以体积比1:2置于恒温恒容密闭容器中反应,若测得该反应平衡时H2O与COS的体积比1:6,则该温度下,脱除反应的平衡常数K=__(保留两位小数)。
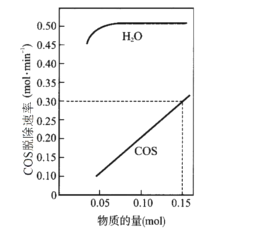
(2)T℃时,以一定流速、不同物质的量的H2O(g)和COS(g)通过流化床,测得COS(g)脱除速率变化关系如图。
已知:COS脱除反应机理如下,其中吸附在催化剂表面的物种用*标注。
a.吸附:H2O→H2O*
b.反应:COS+H2O*→CO2+H2S*
c.脱附:H2S*→H2S
①若COS(g)脱除速率v=knx(COS)ny(H2O)(molmin-1),由图中的数据可算出x、k的值:x=__,k=__。
②“吸附”步骤为__(填“快反应”或“慢反应”),理由是__。
③脱除反应的决速步骤为__(填“a”、“b”或“c”)。
④少量氢气可以抑制催化剂积硫(S*)中毒,分析该流化床中可能存在的可逆反应是__。
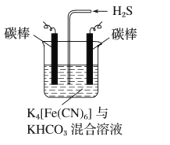
(3)工业上常采用下图所示电解装置,将气态废弃物中的硫化氢转化为可利用的硫。首先通电电解K4[Fe(CN)6]与KHCO3的混合溶液,通电一段时间后,再向所得溶液通入H2S时发生反应的离子方程式为2[Fe(CN)6]3-+2CO32-+H2S═2[Fe(CN)6]4-+2HCO3-+S↓.电解过程中阴极区电极反应式为_。
【答案】-35 2.67 1 2 快反应 H2O(g)的物质的量不影响总反应速率 b S*+H2![]() H2S* 2HCO3-+2e-=H2↑+2CO32-
H2S* 2HCO3-+2e-=H2↑+2CO32-
【解析】
(1)①已知:①H2(g)+COS(g)H2S(g)+CO(g)△H1=+6.2kJmol-1
②H2(g)+CO2(g)H2O(g)+CO(g)△H2=+41.2kJmol-1
根据盖斯定律,反应①-②即可得COS精度脱除反应H2O(g)+COS(g)H2S(g)+CO2(g)△H=(6.2-41.2)kJ/mol=-35kJ/mol,故答案为:-35;
②根据题意列三段式:
H2O(g)+COS(g)=H2S(g)+CO2(g)(单位:mol)
起始量: 1 2 0 0
转化量: x x x x
平衡量:1-x 2-x x x
则![]() ,解得x=0.8,平衡常数K=
,解得x=0.8,平衡常数K=![]() =2.67,
=2.67,
故答案为:2.67;
(2)①根据图示,当H2O的物质的量固定时,COS(g)脱除速率为COS(g)物质的量的2倍,则x=1,k=2,故答案为:1;2;
②根据图示,由于H2O(g)的物质的量不影响总反应速率,因此“吸附”步骤是快反应,
故答案为:快反应;H2O(g)的物质的量不影响总反应速率;
③根据COS(g)脱除速率与COS(g)物质的量的关系可知脱除反应的决速步骤为b,
故答案为:b;
④少量氢气可以抑制催化剂积硫(S*)中毒,该过程可逆反应可能时S*+H2H2S*,
故答案为:S*+H2H2S*;
(3)根据信息可知,电解后溶液中存在CO32-,结合阴极化合价降低,电极反应式为2HCO3-+2e-=H2↑+2CO32-,
故答案为:2HCO3-+2e-=H2↑+2CO32-。


科目:高中化学 来源: 题型:
【题目】H2S是一种剧毒气体,对H2S废气资源化利用途径之一是回收能量并得到单质硫,反应原理为:2H2S(g)+O2(g)=S2(s)+2H2O(l)△H=-632kJmol-1.如图为质子膜H2S燃料电池的示意图。下列说法正确的是

A.电极a上发生的电极反应为:2H2S-4e-=S2+4H+
B.电池工作时,电流从电极a经负载流向电极b
C.当反应生成64gS2时,电池内部释放632kJ热能
D.当电路中通过4mol电子时,有4molH+经质子膜进入负极区
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】相对分子质量约为4000的聚乙二醇具有良好的水溶性,是一种缓泻剂。聚乙二醇可由环氧乙烷在酸性条件下聚合而成(![]() )。下列说法正确的是
)。下列说法正确的是
A.环氧乙烷在酸性条件下发生加聚反应制得聚乙二醇
B.聚乙二醇的结构简式为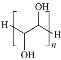
C.相对分子质量约为4000的聚乙二醇的聚合度n≈67
D.聚乙二醇能保持肠道水分的原因是其可和H2O分子间形成氢键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向某浓度的二元弱酸H2C2O4溶液中逐滴加入NaOH溶液,pC与溶液pH的变化关系如图所示(pC=-lgx,x表示溶液中溶质微粒的物质的量浓度)。下列说法正确的是
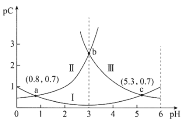
A.常温下,H2C2O4的Ka1=100.8
B.pH=3时,溶液中![]()
C.pH由0.8增大到5.3的过程中,水的电离程度逐渐增大
D.常温下,随着pH的增大,![]() 的值先增大后减小
的值先增大后减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是氯化铯晶体的晶胞(晶体中的最小重复单元),已知晶体中两个最近的Cs+离子核间距离为a cm,氯化铯的相对分子质量为M,NA为阿伏加德罗常数,则氯化铯晶体密度是( )

A. ![]() g/cm3 B.
g/cm3 B. ![]() g/cm3 C.
g/cm3 C. ![]() g/cm3 D.
g/cm3 D. ![]() g/cm3
g/cm3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“84”消毒液、医用酒精等能对新冠病毒进行有效消杀。某兴趣小组在实验室自制“84”消毒液。请回答以下问题:
(1)“84”消毒液消杀新冠病毒的原理是__。
(2)甲同学设计图1所示实验装置(夹持装置省略)制取“84”消毒液。
①B中的试剂是__。
②干燥管的作用是__。
③当C中NaOH溶液吸收完全后,停止通氯气,检验氯气已过量的方法为__。
(3)乙同学设计图2所示电解装置制取“84”消毒液。
①铁电极作__极。
②该电解制取NaClO的总反应的化学方程式为__。
③充分电解后,为检验电解液中是否还残留少量Cl-,取少量电解后溶液于试管中,滴加AgNO3溶液,试管中产生白色沉淀并有无色气体产生,该气体能使带火星的木条复燃。试管中发生反应的离子方程式为___。
④取25.00mL电解后溶液,加入过量KI与稀硫酸混合溶液,充分反应后加入2滴淀粉液,用0.1000molL-1Na2S2O3溶液滴定,消耗12.00mL。则该电解液有效氯(以有效氯元素的质量计算)的浓度为___mg/L。(已知:2S2O32-+I2═S4O62-+2I-)
(4)与甲同学制法相比,乙同学制法的优点除了有装置与操作简单外还有:__、__(请列举出两种)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汉黄芩素是传统中草药黄芩的有效成分之一,对肿瘤细胞的杀伤有独特作用。下列有 关汉黄芩素的叙述正确的是
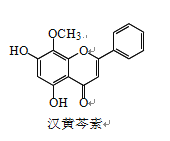
A. 汉黄芩素的分子式为 C16H13O5
B. 该物质遇 FeCl3 溶液显色
C. 1 mol 该物质与溴水反应,最多消耗 1 mol Br2
D. 与足量 H2 发生加成反应后,该分子中官能团的种类减少 1 种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组利用如图装置进行乙醇的催化氧化实验制取乙醛,图中铁架台等装置已略去,粗黑线表示乳胶管。请填写下列空白:
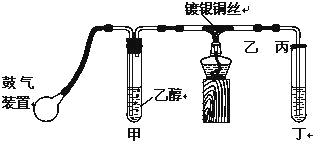
(1)甲装置常常浸在7080℃的水浴中,目的是___________
(2)实验时,先加热玻璃管乙中的镀银铜丝,约1分钟后鼓入空气,此时铜丝即呈红热状态。若把酒精灯撤走,控制一定的鼓气速度,铜丝能长时间保持红热直到实验结束。乙醇的催化氧化反应是__________反应(填“放热”或“吸热”),该反应的化学方程式为________
(3)该小组将丁中收集到的产物继续做实验探究:
①在试管中加入2毫升10%的_____溶液,在滴加四到五滴2%的_______溶液,配制成氢氧化铜悬浊液。然后加入丁中的产物,在酒精灯上加热,可以看到_________
②写出丁种物质与新制氢氧化铜反应的化学方程式___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纳米TiO2是一种重要的光催化剂。以钛酸酯Ti(OR)4为原料制备纳米TiO2的步骤如下:
①组装装置如图所示,保持温度约为65℃,先将30mL钛酸四丁酯[Ti(OC4H9)4]加入盛有无水乙醇的三颈烧瓶,再加入3mL乙酰丙酮,充分搅拌;
②将含水20%的乙醇溶液缓慢滴入三颈烧瓶中,得到二氧化钛溶胶;
③将二氧化钛溶胶干燥得到二氧化钛凝胶,灼烧凝胶得到纳米TiO2。
已知:钛酸四丁酯能溶于除酮类物质以外的大部分有机溶剂,遇水剧烈水解;Ti(OH)4不稳定,易脱水生成TiO2。回答下列问题:
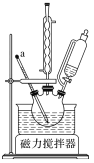
(1)仪器a的名称是__,冷凝管的作用是__。
(2)加入的乙酰丙酮可以减慢水解反应的速率,其原理可能是__(填字母)。
A.增加反应的焓变
B.增大反应的活化能
C.减小反应的焓变
D.降低反应的活化能
制备过程中,减慢水解反应速率的措施还有_。
(3)步骤②中制备二氧化钛溶胶的化学方程式为__。如图所示实验装置中,可用于灼烧二氧化钛凝胶的是__(填字母)。

(4)测定样品中TiO2纯度的方法是:精确称取0.2000g样品放入锥形瓶中,加入硫酸和硫酸铵的混合溶液,加强热使其溶解。冷却后,加入一定量稀盐酸得到含TiO2+的溶液。加入金属铝,将TiO2+全部转化为Ti3+。待过量的金属铝完全溶解并冷却后,加入指示剂,用0.1000mol·L-1NH4Fe(SO4)2溶液滴定至终点。重复操作2次,消耗0.1000mol·L-1NH4Fe(SO4)2溶液的平均值为20.00mL(已知:Ti3++Fe3++H2O=TiO2++Fe2++2H+)。
①加入金属铝的作用除了还原TiO2+外,另一个作用是__。
②滴定时所用的指示剂为__(填字母)。
a.酚酞溶液 b.KSCN溶液 c.KMnO4溶液 d.淀粉溶液
③样品中TiO2的质量分数为__%。(Ti相对分子质量为48)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com