
ȼ�ϵ�ؾ��й����ķ�չǰ;����ѧ�ҽ������Ƴ�һ���͵�ȼ�ϵ�أ����ü״�ȡ��������ȼ�Ͽ��Լ����ƣ��õ������ȡ����ͳ��أ�ijѧ����ʵ�������ü��Լ״�ȼ�ϵ�ص��Na2SO4��Һ��

�����ͼʾ�ش��������⣺
(1)ͼ��a�缫��________(�����������������������������������)���õ缫�Ϸ����ĵ缫��ӦʽΪ________��
(2)���������£�ͨ��״���һ�������ĵ缫��ӦʽΪ________��
(3)������3.36 L����ʱ(���ۺ�Ϊ��״��)�������ϵ��Na2SO4��Һ��������������ʵ�����________mol��������Һ��PH________(������С��)��
(4)25�桢101 kPaʱ��ȼ��16 g�״�����CO2��H2O(l)���ų�������Ϊ363.26 kJ��д���״�ȼ�յ��Ȼ�ѧ����ʽ��________��
 �ϴ�̸�������������νӽ̳��Ͼ���ѧ������ϵ�д�
�ϴ�̸�������������νӽ̳��Ͼ���ѧ������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2010���������и߿�Ԥ�⣨�ۺ��⣩��ѧ�� ���ͣ������
������һ����Ҫ����ԭ�ϣ��ڹ�ũҵ�����о�����Ҫ��Ӧ�á�
��1����֪��N2(g)+O2(g)="2NO(g) " �� H��180.5kJ��mol��1
4NH3(g)+5O2(g)=4NO(g)+6H2O(g) ��H=��905 kJ��mol��1
2H2(g)+O2(g)=2H2O(g) ��H=��483.6kJ��mol��1
��N2(g)+3H2(g)=2NH3(g)�ġ�H=_________________________��
��2����ҵ�ϳɰ����ķ�ӦΪN2(g)+3H2(g)  2NH3(g)����һ���¶��£���һ������N2��H2ͨ�뵽���Ϊ1L���ܱ������дﵽƽ��ı�������������ʹƽ��������Ӧ�����ƶ���ƽ�ⳣ���������__________________��
2NH3(g)����һ���¶��£���һ������N2��H2ͨ�뵽���Ϊ1L���ܱ������дﵽƽ��ı�������������ʹƽ��������Ӧ�����ƶ���ƽ�ⳣ���������__________________��
������ѹǿ ������Ӧ���Ũ�� ��ʹ�ô��� �ܽ����¶�
( 3 )��ʵ���ҳ��ü����Ȼ�粒�����������ƹ���Ļ��������ȡ������д����Ӧ�Ļ�ѧ����ʽ ? ��ʵ���һ����� ? ����һ���Լ����еμ�Ũ��ˮ�ķ���������ȡ����������
�ڳ����°�����������ˮ����Һ���Ե��硣��ˮ��ˮ�������c(OH��) 10��7 mol��L-1����д����������������������
�۽���ͬ�����PH֮��Ϊ14�İ�ˮ�������Ϻ���Һ������Ũ���ɴ�С��˳��
Ϊ ��
��4���ϳɰ���ԭ��������һ�����͵���ɫ��Դ�����й����ķ�չǰ������������ȼ�ϵ�ؽ���ͼ��ʾʵ�飺(����a��b��Ϊ̼��)
������ȼ�ϵ�ؾ��й����ķ�չǰ��������ͼ��ʾ:
�ұ�Cu�缫��Ӧʽ�� ��
a�缫�ĵ缫��Ӧʽ
�ڹ�ҵ�����������ǽ�ˮ����ͨ�����ȵ�̿������ˮú����
C(s) + H2O(g)  H2(g) + CO(g) ��H =" +131.3" kJ/mol
H2(g) + CO(g) ��H =" +131.3" kJ/mol
�÷�Ӧ�ڵ����²����Է����е�ԭ���� ��
| A����H >0 | B���¶Ƚϵ�ʱ����HӰ��Ϊ�� |
| C����S<0 | D���¶Ƚϵ�ʱ����SӰ��Ϊ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
������һ����Ҫ����ԭ�ϣ��ڹ�ũҵ�����о�����Ҫ��Ӧ�á�
��1����֪��N2(g)+O2(g)=2NO(g) �� H��180.5kJ��mol��1
4NH3(g)+5O2(g)=4NO(g)+6H2O(g) ��H=��905 kJ��mol��1
2H2(g)+O2(g)=2H2O(g) ��H=��483.6kJ��mol��1
��N2(g)+3H2(g)=2NH3(g)�ġ�H=_________________________��
��2����ҵ�ϳɰ����ķ�ӦΪN2(g)+3H2(g) ![]() 2NH3(g)����һ���¶��£���һ������N2��H2ͨ�뵽���Ϊ1L���ܱ������дﵽƽ��ı�������������ʹƽ��������Ӧ�����ƶ���ƽ�ⳣ���������_________ _________��
2NH3(g)����һ���¶��£���һ������N2��H2ͨ�뵽���Ϊ1L���ܱ������дﵽƽ��ı�������������ʹƽ��������Ӧ�����ƶ���ƽ�ⳣ���������_________ _________��
������ѹǿ ������Ӧ���Ũ�� ��ʹ�ô��� �ܽ����¶�
( 3 )��ʵ���ҳ��ü����Ȼ�粒�����������ƹ���Ļ��������ȡ������д����Ӧ�Ļ�ѧ����ʽ ��ʵ���һ����� ����һ���Լ����еμ�Ũ��ˮ�ķ���������ȡ����������
�� �����°�����������ˮ����Һ���Ե��硣��ˮ��ˮ�������c(OH��) 10��7 mol��L-1����д����������������������
�� ����ͬ�����PH֮��Ϊ14�İ�ˮ�������Ϻ���Һ������Ũ���ɴ�С��˳��
Ϊ ��
��4���ϳɰ���ԭ��������һ�����͵���ɫ��Դ�����й����ķ�չǰ������������ȼ�ϵ�ؽ���ͼ��ʾʵ�飺(����a��b��Ϊ̼��)

������ȼ�ϵ�ؾ��й����ķ�չǰ��������ͼ��ʾ:
�ұ�Cu�缫��Ӧʽ�� ��
a�缫�ĵ缫��Ӧʽ
�ڹ�ҵ�����������ǽ�ˮ����ͨ�����ȵ�̿������ˮú����
C(s) + H2O(g) ![]() H2(g) + CO(g) ��H = +131.3 kJ/mol
H2(g) + CO(g) ��H = +131.3 kJ/mol
�÷�Ӧ�ڵ����²����Է����е�ԭ���� ��
A����H >0 B���¶Ƚϵ�ʱ����HӰ��Ϊ��
C���� S<0 D���¶Ƚϵ�ʱ����SӰ��Ϊ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
������һ����Ҫ����ԭ�ϣ��ڹ�ũҵ�����о�����Ҫ��Ӧ�á�
��1����֪��N2(g)+O2(g)=2NO(g) �� H��180.5kJ��mol��1
4NH3(g)+5O2(g)=4NO(g)+6H2O(g) ��H=��905 kJ��mol��1
2H2(g)+O2(g)=2H2O(g) ��H=��483.6kJ��mol��1
��N2(g)+3H2(g)=2NH3(g)�ġ�H=_________________________��
��2����ҵ�ϳɰ����ķ�ӦΪN2(g)+3H2(g) ![]() 2NH3(g)����һ���¶��£���һ������N2��H2ͨ�뵽���Ϊ1L���ܱ������дﵽƽ��ı�������������ʹƽ��������Ӧ�����ƶ���ƽ�ⳣ���������_________ _________��
2NH3(g)����һ���¶��£���һ������N2��H2ͨ�뵽���Ϊ1L���ܱ������дﵽƽ��ı�������������ʹƽ��������Ӧ�����ƶ���ƽ�ⳣ���������_________ _________��
������ѹǿ ������Ӧ���Ũ�� ��ʹ�ô��� �ܽ����¶�
( 3 )��ʵ���ҳ��ü����Ȼ�粒�����������ƹ���Ļ��������ȡ������д����Ӧ�Ļ�ѧ����ʽ ?? ��ʵ���һ����� ?? ����һ���Լ����еμ�Ũ��ˮ�ķ���������ȡ����������
�� �����°�����������ˮ����Һ���Ե��硣��ˮ��ˮ�������c(OH��) 10��7 mol��L-1����д����������������������
�� ����ͬ�����PH֮��Ϊ14�İ�ˮ�������Ϻ���Һ������Ũ���ɴ�С��˳��
Ϊ ��
��4���ϳɰ���ԭ��������һ�����͵���ɫ��Դ�����й����ķ�չǰ������������ȼ�ϵ�ؽ���ͼ��ʾʵ�飺(����a��b��Ϊ̼��)
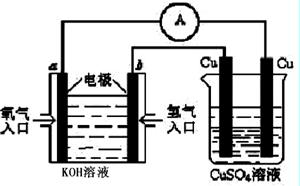
������ȼ�ϵ�ؾ��й����ķ�չǰ��������ͼ��ʾ:
�ұ�Cu�缫��Ӧʽ�� ��
a�缫�ĵ缫��Ӧʽ
�ڹ�ҵ�����������ǽ�ˮ����ͨ�����ȵ�̿������ˮú����
C(s) + H2O(g) ![]() H2(g) + CO(g) ��H = +131.3 kJ/mol
H2(g) + CO(g) ��H = +131.3 kJ/mol
�÷�Ӧ�ڵ����²����Է����е�ԭ���� ��
A����H >0 B���¶Ƚϵ�ʱ����HӰ��Ϊ��
C���� S<0 D���¶Ƚϵ�ʱ����SӰ��Ϊ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com