
分析 (1)由热化学方程式可知:①2H2(g)+O2(g)→2H2O(g)+483.6kJ,②H2(g)+$\frac{1}{2}$O2(g)→H2O(l)+285.8kJ,根据盖斯定律:2②-①可知:2H2O(g)=2H2O(l)+88kJ,所以1g气态水变成液态水需放出热量,放出热量为:$\frac{88}{36}$=2.44kJ,由此分析解答;
(2)1.32g焦炭的物质的量为:$\frac{1.32g}{12g/mol}$=0.11mol,也就是完全燃烧0.11mol焦炭放出热量为2.44kJ,由此书写热化学方程式.
解答 解:(1)由热化学方程式可知:①2H2(g)+O2(g)→2H2O(g)+483.6kJ,②H2(g)+$\frac{1}{2}$O2(g)→H2O(l)+285.8kJ,根据盖斯定律:2②-①可知:2H2O(g)=2H2O(l)+88kJ,所以1g气态水变成液态水需放出热量,放出热量为:$\frac{88}{36}$=2.44kJ,故答案为:放出;2.44;
(2)1.32g焦炭的物质的量为:$\frac{1.32g}{12g/mol}$=0.11mol,也就是完全燃烧0.11mol焦炭放出热量为2.44kJ,所以1mol的焦炭燃烧放出热量为:400KJ,所以热化学方程式为:C((s)+O2(g)═CO2(g)+400KJ,故答案为:C((s)+O2(g)═CO2(g)+400KJ.
点评 本题考查了盖斯定律的运用和热化学方程式的计算,掌握基础是关键,题目较简单.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 容器中可能有固体残渣 | B. | 所得溶液中一定存在Fe2+ | ||
| C. | 反应过程中水的电离程度增大 | D. | 再加入铜后,溶液红色逐渐退去 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
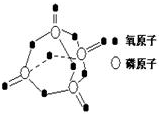 研究表明,化学反应的能量变化(△H)与反应物和生成物的键能有关.键能可以简单的理解为断开1mol化学键时所需吸收的能量.下表是部分化学键的键能数据:
研究表明,化学反应的能量变化(△H)与反应物和生成物的键能有关.键能可以简单的理解为断开1mol化学键时所需吸收的能量.下表是部分化学键的键能数据:| 化学键 | P-P | P-O | O=O | P=O |
| 键能/kJ•mol-1 | 197 | 360 | 499 | X |
| A. | 1057.5 kJ•mol-1 | B. | 335.25 kJ•mol-1 | C. | 433.75 kJ•mol-1 | D. | 959.0 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

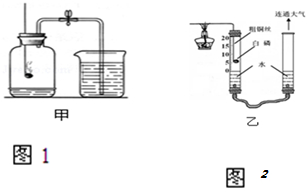
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只发生水合过程 | B. | 只发生化学过程 | ||
| C. | 水合过程放热大于扩散过程吸热 | D. | 扩散过程吸热大于水合过程放热 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
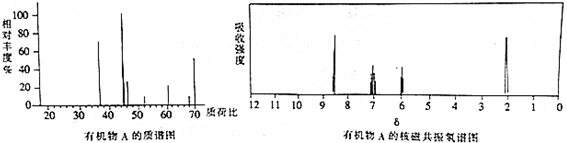
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
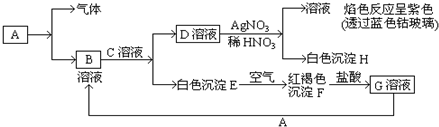
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu2+、Na+、NO3-、SO42- | B. | Ba2+、NH4+、Cl-、SO42- | ||
| C. | Na+、K+、ClO-、SO42- | D. | H+、Na+、I-、NO3- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com