£Ø2009?ÉīŪŚ¶žÄ££©ĀČ¼ī³§·ĻŌü£ØŃĪÄą£©ÖŠŗ¬ÓŠĆ¾øĘĢśĀĮµÄ¹čĖįŃĪŗĶĢ¼ĖįŃĪ£¬ĘäÖŠŗ¬Ć¾£ØŅŌMgO¼Ę£©Ō¼10%£¬øĘ£ØŅŌCaO¼Ę£©Ō¼15%£¬Ģś£Ø¢ņ”¢¢ó£©ŗĶĀĮµČµÄŗ¬ĮæµĶÓŚ1%£®ĀČ¼ī³§“ÓŃĪÄąÖŠĢįČ”MgSO
4£®7H
2OµÄĮ÷³ĢČēĻĀ£ŗ
²æ·ÖŃōĄė×ÓŅŌĒāŃõ»ÆĪļ³ĮµķŹ±ČÜŅŗpH
| ³ĮµķĪļ |
Al£ØOH£©3 |
Fe£ØOH£©3 |
Fe£ØOH£©2 |
Mg£ØOH£©2 |
| pH |
5.2 |
3.2 |
9.7 |
11.2 |
Čܽā¶Č±ķ
| ĪĀ¶Č0C |
10 |
30 |
40 |
| CaSO4 |
0.19 |
0.21 |
0.21 |
»Ų“šĻĀĮŠĪŹĢā£ŗ
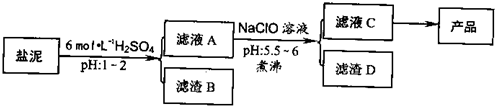
£Ø1£©ĀĖŌüBµÄÖ÷ŅŖ³É·ÖŹĒ£ŗ
H2SiO3£Ø»ņH4SO4£©\CaSO4£Ø»ņCaSO4?2H2O£©
H2SiO3£Ø»ņH4SO4£©\CaSO4£Ø»ņCaSO4?2H2O£©
£®
£Ø2£©“ÓĀĖŅŗAµĆµ½ĀĖŅŗC£¬ÄÜ·ńÓĆ°±Ė®“śĢęNaClO£æ
·ń
·ń
£¬Ź²Ć“ĄķÓÉ
°±Ė®²»Äܽ«Fe2+Ńõ»Æ³ÉFe3+£¬ŌņĪŽ·Ø³ĮµķĶźČ«
°±Ė®²»Äܽ«Fe2+Ńõ»Æ³ÉFe3+£¬ŌņĪŽ·Ø³ĮµķĶźČ«
£¬ĘäÖŠ¼ÓČČÖ󷊵ÄÄæµÄŹĒ
¼ÓČČÄÜŹ¹Fe3+ŗĶAl3+Ė®½āĶźČ«£¬Ķ¬Ź±ŅņĪŖĒāŃõ»ÆĢśŗĶĒāŃõ»ÆĀĮŹĒ½ŗד³Įµķ£¬¼ÓČČÓŠĄūÓŚĘĘ»µ½ŗĢåµÄĪČ¶ØŠŌ£¬Ź¹³ĮµķæÅĮ£±ä“óĄūÓŚŗóĆę¹żĀĖ·ÖĄė
¼ÓČČÄÜŹ¹Fe3+ŗĶAl3+Ė®½āĶźČ«£¬Ķ¬Ź±ŅņĪŖĒāŃõ»ÆĢśŗĶĒāŃõ»ÆĀĮŹĒ½ŗד³Įµķ£¬¼ÓČČÓŠĄūÓŚĘĘ»µ½ŗĢåµÄĪČ¶ØŠŌ£¬Ź¹³ĮµķæÅĮ£±ä“óĄūÓŚŗóĆę¹żĀĖ·ÖĄė
£®
£Ø3£©“ÓĀĖŅŗCÖŠ»ńµĆ²śĘ·¾¹ż3øö²Ł×÷²½Öč£¬·Ö±šŹĒ
¼ÓČČÅØĖõ
¼ÓČČÅØĖõ
£¬
ĄäČ“½į¾§
ĄäČ“½į¾§
£¬
¹żĀĖ
¹żĀĖ
£®
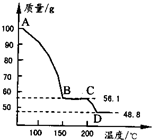
£Ø4£©½«Ņ»¶ØÖŹĮæµÄMgSO
4£®7H
2O·ÅŌŚŪįŪöÖŠ¼ÓČČ²āµĆ²»Ķ¬ĪĀ¶Č½×¶ĪŹ£Óą¹ĢĢåÖŹĮæČēĶ¼ĖłŹ¾£®
¾ŻĶ¼Š“³öCD¶Ī·“Ó¦µÄ»Æѧ·½³ĢŹ½
£®





