
【题目】—定温度下,下列溶液的离子浓度关系式正确的是( )
A. pH=5 的H2S溶液中,c(H+)>c(HS-)=1×10-5mol/L
B. 将等物质的量的Na2CO3和NaHCO3混合溶于水中:![]()
C. pH之和为14的H2C2O4与NaOH 溶液混合:c(Na+)>c(H+)>c(OH-)>c(HC2O4-)
D. 0.1 mol / L 的硫酸铵溶液中:c(SO42-)>c(NH4+)> c(H+)> c(OH-)
科目:高中化学 来源: 题型:
【题目】如图装置,通电后,发现Cu极附近溶液蓝色加深。下列说法正确的是
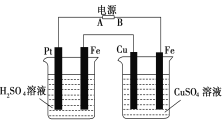
A.A极为负极,Cu为阳极
B.左烧杯溶液和右烧杯溶液的pH都变小
C.左烧杯Pt极和右烧杯Fe极的电解产物物质的量之比为1:1
D.左烧杯溶液浓度变大,右烧杯溶液浓度不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,根据表中的几种物质的电离平衡常数回答下列问题:
NH3·H2O | 2×10-5 |
HNO2 | 7×10-4 |
HClO | 3×10-8 |
H2CO3 | K1=4×10-7 K2=4×10-11 |
(1)常温下,等浓度的NH4NO3和NH4NO2两份溶液,测得NH4NO2溶液中c(NH![]() )较小,试分析原因: 。0.1mol·L-1NH4NO2溶液中离子浓度由大到小的顺序是 ,NO
)较小,试分析原因: 。0.1mol·L-1NH4NO2溶液中离子浓度由大到小的顺序是 ,NO![]() 水解反应的平衡常数Kh= mol·L-1(保留两位有效数字)。
水解反应的平衡常数Kh= mol·L-1(保留两位有效数字)。
(2)常温下,用氨水吸收CO2得到NH4HCO3溶液,其pH 7 (填“>”、“<”或“=”);反应NH3·H2O+H2CO3![]() NH
NH![]() +HCO
+HCO![]() +H2O的平衡常数K= 。
+H2O的平衡常数K= 。
(3) 少量CO2通入到过量的NaClO溶液中发生反应的离子方程式 :
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.有浓度均为0.1mol/L的盐酸、硫酸、醋酸三种溶液:
(1)若三种溶液氢离子浓度依次为a1、a2、a3 mol/L,则它们的大小关系为___________________。
(2)等体积的以上三种酸分别与过量的NaOH溶液反应,若生成盐的物质的量依次为b1、b2、b3mol,则它们的大小关系是___________________。
(3)分别用以上三种酸中和一定量的NaOH溶液生成正盐,若需酸溶液的体积依次为V1、V2、V3L,则其大小关系是_________________。
(4)分别与锌反应,开始是产生H2的速率为ν1、ν2、ν3, 则其大小关系是_________________。
(5)若三种溶液由水电离出的H+浓度依次为c1、c2、c3mol/L,则它们的大小关系是_____________。
II.相同条件下的pH=3的盐酸和pH=3的醋酸:
(1)取等体积两溶液,分别稀释pH=4时,两者加水量的关系是:前者________后者(填>、<或=,下同)
(2)取等体积的两溶液,分别加入等物质的量的相应钠盐固体少量,两溶液的pH大小关系是:前者_________后者;
(3)各取两溶液VL,分别加入VLpH=11的NaOH,充分反应后,两溶液pH大小关系是:前者______ ____后者。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关物质的转化关系如下图所示(部分物质与条件己略去)。A是常见的金属单质, B是常见的强酸,D是常见的气体单质,E是空气中含量最多的气体,I是既能与强酸又能与强碱反应的氧化物,G是最常见的无色液体,J是一种高硬度材料(摩尔质量为41g/ mol)。

请回答下列问题:
(1)D的化学式为___________。
(2)F的电子式为___________。
(3)G的结构式为___________。
(4)写出反应①的离子方程式:___________。
(5)写出反应②的化学方程式:___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某模拟“人工树叶”电化学实验装置如图所示,该装置能将H2O和CO2转化为O2和燃料(C3H8O)。下列说法正确的是( )

A. 该装置将化学能转化为光能和电能
B. 该装置工作时,H+从b极区向a极区迁移
C. 每生成1molO2,有44g CO2被还原
D. a电极的反应为:3CO2+18H+-18e-=C3H8O+5H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于常温下pH=2的醋酸溶液,下列叙述正确的是
A.c(H+)=c(CH3COO-)
B.加水稀释时![]() 增大
增大
C.与pH = 12的NaOH溶液等体积混合后,溶液呈中性
D.加入醋酸钠固体可抑制醋酸的电离,电离常数Ka变小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 铅蓄电池充电时,阳极质量增大
B. 0.1mol ·L-lCH3COONa溶液加热后,溶液的pH减小
C. 标准状况下,11.2L苯中含有的碳原子数为3×6.02×1023
D. 室温下,稀释0.1mol·L-1氨水,c(H+)·c(NH3·H2O)的值减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I. NH3作为一种重要化工原料,被大量应用于工业生产,与其有关性质反应的催化剂研究曾被列入国家863计划。
(1)催化剂常具有较强的选择性,即专一性。
已知:反应①:4NH3(g) +5O2(g)![]() 4NO(g) +6H2O(g) △H=-905.0 kJ·molˉ1
4NO(g) +6H2O(g) △H=-905.0 kJ·molˉ1
反应②:4NH3(g)+3O2(g)![]() 2N2(g) +6H2O(g) △H=-1266.6 kJ·molˉ1
2N2(g) +6H2O(g) △H=-1266.6 kJ·molˉ1
写出NO分解生成N2与O2的热化学方程式:______________________________。
(2)在恒温恒容装置中充入一定量的NH3和O2,在某催化剂的作用下进行反应①,测得不同时间的NH3和O2的浓度如下表:
时间(min) | 0 | 5 | 10 | 15 | 20 | 25 |
C(NH3)/mol·L-1 | 1.00 | 0.36 | 0.12 | 0.08 | 0.072 | 0.072 |
C(O2)/mol·L-1 | 2.00 | 1.20 | 0.90 | 0.85 | 0.84 | 0.84 |
则下列有关叙述正确的是___________(填选项字母)。
A.使用催化剂,可加快反应速率
B.若测得容器内4v正(NH3)=6v逆(H2O)时,说明反应已达平衡
C.当容器内![]() =1时,说明反应已达平衡
=1时,说明反应已达平衡
D.前10分钟内的平均反应速率v(NO)=0.088mol·L-1·min-1
II.实验室通常用MnO2作催化剂分解H2O2,已知CuSO4溶液对过氧化氢的分解也具有催化作用,某实验兴趣小组的同学猜想其他盐溶液也可能在这个反应中起同样的作用,于是他们做了以下探究。请你帮助他们完成实验报告:
(1)实验过程:在一支试管中加入5 mL 5%的H2O2溶液,然后滴入适量的FeCl3溶液,把带火星的木条伸入试管。
实验现象:__________________________________________________。
实验结论:FeCl3溶液可以催化分解H2O2。
(2)已知FeCl3溶液在水中可解离出Fe3+和Cl-,同学们提出以下猜想:
span> | 促进H2O2分解的微粒 |
甲同学 | H2O |
乙同学 | Fe3+ |
丙同学 | Cl- |
你认为最不可能的是_______同学的猜想,理由是____________________________。
(3)同学们对余下的两个猜想用实验进行了探究,请你仔细分析后完成表格:
实验过程 | 实验现象 | 结论 |
向盛有5 mL 5%的H2O2溶液的试管中滴入少量的 HCl,把带火星的木条伸入试管. | 无明显现象 | _______________ |
向盛有5 mL 5%的H2O2溶液的试管中滴入少量的Fe2(SO4)3,把带火星的木条伸入试管. | _______________ | _______________ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com