
【题目】某研究小组进行Mg(OH)2沉淀溶解和生成的实验探究。
向2支盛有1 mL 1 mol·L-1的MgCl2溶液中各加入10滴2 mol·L-1NaOH,制得等量Mg(OH)2沉淀;然后分别向其中加入不同试剂,记录实验现象如下表:
实验序号 | 加入试剂 | 实验现象 |
Ⅰ | 4 mL 2 mol·L-1HCl 溶液 | 沉淀溶解 |
Ⅱ | 4 mL 2 mol·L-1NH4Cl 溶液 | 沉淀溶解 |
(1)从沉淀溶解平衡的角度解释实验Ⅰ的反应过程_____________。
(2)测得实验Ⅱ中所用NH4Cl溶液显酸性(pH约为4.5),用离子方程式解释其显酸性的原因___________。
(3)甲同学认为应补充一个实验:向同样的Mg(OH)2沉淀中加4 mL蒸馏水,观察到沉淀不溶解。该实验的目的是_________。
(4)同学们猜测实验Ⅱ中沉淀溶解的原因有两种:一是NH4Cl溶液显酸性,溶液中的H+可以结合OH- ,进而使沉淀溶解;二是____________。
(5)乙同学继续进行实验:向4 mL 2 mol·L-1 NH4Cl溶液中滴加2滴浓氨水,得到pH约为8的混合溶液,向同样的Mg(OH)2沉淀中加入该混合溶液,观察现象。
①实验结果证明(4)中的第二种猜测是成立的,乙同学获得的实验现象是___________。
③乙同学这样配制混合溶液的理由是___________。
【答案】Mg(OH)2(s)![]() Mg2+(aq)+2OH -(aq),盐酸中的H+与OH-中和使得OH-浓度减小平衡右移,沉淀溶解 NH4++H2O
Mg2+(aq)+2OH -(aq),盐酸中的H+与OH-中和使得OH-浓度减小平衡右移,沉淀溶解 NH4++H2O![]() NH3·H2O+H+ 排除实验Ⅰ、Ⅱ中溶剂水使沉淀溶解的可能性 溶液中c(NH4+)较大,NH4+结合OH-使沉淀溶解 沉淀溶解 混合溶液显碱性,c(H+)非常小(或答“H+不与OH-结合”), c(NH4+)较大(或答“c(NH4+)与NH4Cl溶液接近”)能确定是NH4+结合OH-使沉淀溶解
NH3·H2O+H+ 排除实验Ⅰ、Ⅱ中溶剂水使沉淀溶解的可能性 溶液中c(NH4+)较大,NH4+结合OH-使沉淀溶解 沉淀溶解 混合溶液显碱性,c(H+)非常小(或答“H+不与OH-结合”), c(NH4+)较大(或答“c(NH4+)与NH4Cl溶液接近”)能确定是NH4+结合OH-使沉淀溶解
【解析】
(1)Mg(OH)2存在沉淀溶解平衡:Mg(OH)2(s)![]() Mg2+(aq)+2OH -(aq),加入HCl后,H+与OH反应,使OH浓度减小,沉淀溶解平衡向右移动,Mg(OH)2沉淀溶解。
Mg2+(aq)+2OH -(aq),加入HCl后,H+与OH反应,使OH浓度减小,沉淀溶解平衡向右移动,Mg(OH)2沉淀溶解。
(2)NH4Cl为强酸弱碱盐,NH4+发生水解反应,离子方程式为:NH4++H2O![]() NH3·H2O+H+
NH3·H2O+H+
(3)实验Ⅰ、Ⅱ加入溶液,水增多,所以该实验的目的是:排除实验Ⅰ、Ⅱ中溶剂水使沉淀溶解的可能性。
(4)NH4+能与OH结合,生成弱电解质NH3H2O,所以溶液中c(NH4+)较大,NH4+结合OH-使沉淀溶解。
(5)①所加的混合液pH约为8,为碱性,所以沉淀溶解,可证明第二种猜测成立。
②混合液pH约为8,显碱性,c(H+)非常小,而NH4+少量溶解,c(NH4+)浓度较大,可确定沉淀溶解的原因是NH4+与OH反应,促进沉淀溶解平衡向右移动。


科目:高中化学 来源: 题型:
【题目】胡椒醛衍生物在香料、农药、医药等领域有着广泛用途,A为香草醛,以A为原料合成5-三氟甲基胡椒醛(E)的路线如图所示:

已知:
(1)反应①的类型是 。
(2)写出A中含氧官能团的名称 。
(3)写出反应③的化学方程式 。
(4)写出满足下列条件A的一种同分异构体的结构简式 。
①能与碳酸氢钠溶液反应放出气体
②不与氯化铁溶液发生显色反应
③含苯环,核磁共振氢谱显示其有5种不同化学环境的氢原子
(5)以A和2-氯丙烷为原料,可合成香草醛缩丙二醇( ),写出合成流程图(无机试剂任用)。合成流程图示例如下:
),写出合成流程图(无机试剂任用)。合成流程图示例如下:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物J是一种消炎镇痛药,下图为J的合成路线(部分产物和反应条件省略):

已知部分信息如下:
①![]() (此类物质易与水、酸等反应)
(此类物质易与水、酸等反应)
②![]()
回答下列问题:
(1)A中官能团的名称是_________,D + I→J的反应类型为___________。
(2)反应B→C的化学方程式为__________________。
(3)E→F的反应条件为___________,在质谱仪上E的最大质荷比为________。
(4)J有多种同分异构体,其中满足下列条件,且苯环上一氯代物只有两种的异构体的结构简式为________________。
a.氨基(–NH2)与苯环直接相连;b.能发生银镜反应;c.能发生水解反应
(5)证明G已部分生成H的实验方案是__________________。
(6)参照上述流程,设计以 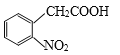 为原料,制备
为原料,制备 的合成路线(无机试剂任选)。_______________________________。
的合成路线(无机试剂任选)。_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将CO2通入2LpH=12的KOH溶液中,溶液中水电离的OH-离子浓度(φ)与通入的CO2的体积(V)的关系如下图所示。下列叙述不正确的是

A.a点溶液中:水电离出的c(H+)=1×10-12mol/L
B.b点溶液中:c(H+)=1×10-7mol/L
C.c点溶液中:c(K+)=2[c(CO32-)+c(HCO3-)+c(H2CO3)]
D.d点溶液中:c(K+)=2c(CO32-)+c(HCO3-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,用相同浓度的NaOH溶液,分别滴定浓度均为0.1mol·L-1的三种酸(HA、HB和HD)溶液,滴定的曲线如图所示,下列判断错误的是( )
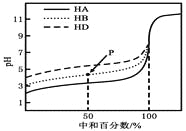
A. 三种酸的电离常数关系:KHA>KHB>KHD
B. 滴定至P点时,溶液中:c(B-)>c(Na+)>c(HB)>c(H+)>c(OH-)
C. pH=7时,三种溶液中:c(A-)=c(B-)=c(D-)
D. 当中和百分数达100%时,将三种溶液混合后:c(HA)+c(HB)+c(HD)=c(OH-)-c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知常温下,Ksp(Ag2SO4)=2.0×10-5。取适量Ag2SO4溶于蒸馏水得到200 mL饱和溶液,在该饱和溶液中c(SO42-)=0.017 mol·L-1。向该饱和溶液中加入0.020 mol·L-1 Na2SO4溶液200 mL,得到溶液R。(不考虑混合后溶液体积的变化)下列说法正确的是( )
A.R中c(Ag+)=2c(SO42-)
B.得到溶液R的过程中会产生沉淀
C.R中c(Ag+)=0.017 mol·L-1
D.加入Na2SO4溶液促进沉淀溶解平衡向左移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2007年诺贝尔化学奖得主Gerhard Ertl对金属Pt表面催化CO氧化反应的模型进行了深入研究。下列关于![]() Pt的说法正确的是( )
Pt的说法正确的是( )
A.![]() Pt和
Pt和![]() Pt的质子数相同,互称为同位素
Pt的质子数相同,互称为同位素
B.![]() Pt和
Pt和![]() Pt的中子数相同,互称为同位素
Pt的中子数相同,互称为同位素
C.![]() Pt和
Pt和![]() Pt的核外电子数相同,是同一种核素
Pt的核外电子数相同,是同一种核素
D.![]() Pt和
Pt和![]() Pt的质量数不同,不能互称为同位素
Pt的质量数不同,不能互称为同位素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下的密闭容器中,一定能说明反应A(g)+3B(g)![]() 2C(g)+2D(g)达到平衡状态的是
2C(g)+2D(g)达到平衡状态的是
A.反应体系的总压恒定B.2v(B)正=3v(C)逆
C.c(A):c(B)=1:3D.单位时间内生成2molC,同时生成2molD
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知常温下,Ksp(AgCl)=1×10-10,Ksp(AgI)=1×10-18。下列叙述中正确的是( )
A. 常温下,AgCl在NaCl溶液中的Ksp比在纯水中的Ksp小
B. 常温下,AgI若要在NaCl溶液中开始转化为AgCl,则NaCl的浓度必须大于0.1mol·L
C. 将0.001 mol·L-1的AgNO3溶液滴入KCl和KI的混合溶液中,一定先析出AgI沉淀
D. 向AgCl饱和溶液中加入NaCl晶体,有AgCl析出且溶液中c(Ag+)=c(Cl-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com