
【题目】纯碱是厨房里的常见物质,请写出纯碱的化学式________,若食盐中可能混入了少量纯碱,用下列厨房中的哪种物质可进行检验________。
A.白酒 B.食醋 C.酱油 D.白糖
科目:高中化学 来源: 题型:
【题目】在探索苯结构的过程中,人们写出了符合分子式“C6H6”的多种可能结构(如图),下列说法正确的是( )

A. 1--5对应的结构中所有原子均可能处于同一平面的有1个
B. 1--5对应的结构均能使溴的四氯化碳溶液褪色
C. 1--5对应的结构中的一氯取代物只有1种的有3个
D. 1--5对应的结构均不能使酸性高锰酸钾溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国学者在水煤气变换[CO(g)+H2O(g)=CO2(g)+H2(g) ΔH]中突破了低温下高转化率与高反应速率不能兼得的难题,该过程是基于双功能催化剂(能吸附不同粒子)催化实现的。反应过程示意图如下:
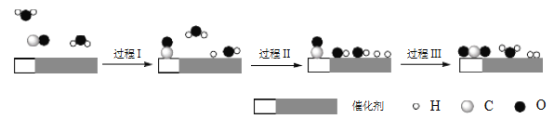
下列说法正确的是
A. 过程Ⅰ、过程Ⅲ均为放热过程
B. 过程Ⅲ生成了具有极性共价键的H2、CO2
C. 使用催化剂降低了水煤气变换反应的ΔH
D. 图示过程中的H2O均参与了反应过程
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SO2广泛用于医药、硫酸工业等领域,回收废气中的SO2可用如下方法。
方法Ⅰ | 用碱式硫酸铝Al2(SO4)x(OH)y溶液吸收富集SO2 |
方法Ⅱ | 在Fe2+或Fe3+催化下,用空气(O2)将SO2氧化为H2SO4 |
(1)方法Ⅰ的过程如下。
① 制备Al2(SO4)x(OH)y
向Al2(SO4)3溶液中加入CaO粉末,调pH至3.6。 CaO的作用之一是促进_______水解(填离子符号,下同),二是沉淀一部分_______。
② 吸收:Al2(SO4)x(OH)y吸收SO2后的产物是_______(写化学式)。
③ 解吸:加热②中产物,产生SO2,Al2(SO4)x(OH)y再生。
(2)方法Ⅱ中,在Fe2+催化下,SO2、O2和H2O生成H2SO4的化学方程式是______。
(3)方法Ⅱ中,Fe2+的催化过程可表示如下:
ⅰ:2 Fe2++ SO2+ O2=2 Fe3++ SO42-
ⅱ: ……
① 写出ⅱ的离子方程式:______。
② 下列实验方案可证实上述催化过程。将实验方案补充完整。
a.向FeCl2溶液滴入KSCN,无变化
b.向FeCl2溶液通入少量SO2,滴入KSCN,颜色变红。
c.取b中溶液,_______。
(4)方法Ⅱ中,催化氧化后,采用滴定法测定废气中残留SO2的含量。将V L(已换算为标准状况)废气中的SO2用1%的H2O2完全吸收,吸收液用下图所示装置滴定,共消耗a mL c mol/L NaOH标准液。
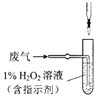
① H2O2氧化SO2的化学方程式_______。
② 废气中残留SO2的体积分数为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学在做实验时引发了镁失火,她立即拿起二氧化碳灭火器欲把火扑灭,却被实验老师及时制止。原因是CO2可以支持镁燃烧,发生2Mg+CO2![]() 2MgO+C,下列关于该反应的判断正确的是( )
2MgO+C,下列关于该反应的判断正确的是( )
A. Mg元素化合价由0价升高到+2价,所以MgO是还原产物
B. 由此反应可以判断氧化性:CO2>MgO,还原性:Mg>C
C. CO2作氧化剂,表现氧化性,发生氧化反应
D. Mg原子失去的电子数目等于氧原子得到的电子数目
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知常温时HClO的Ka=3.0×10-8,HF的Ka=3.5×10-4。现将pH和体积都相同的次氯酸和氢氟酸溶液分别加蒸馏水稀释,pH随溶液体积的变化如图所示。下列叙述正确的是
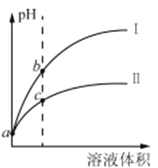
A. 曲线I为次氯酸稀释时pH变化曲线
B. 取a点的两种酸溶液,中和相同体积、相同浓度的NaOH溶液,消耗次氯酸的体积较小
C. a点时,若都加入相同大小的锌粒,此时与氢氟酸反应的速率大
D. b点溶液中水的电离程度比c点溶液中水的电离程度小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对下列各溶液中,微粒的物质的量浓度关系表述正确的是
A. 0.1 mol/L的(NH4)2SO4溶液中:c(SO![]() )>c(NH
)>c(NH![]() )>c(H+)>c(OH-)
)>c(H+)>c(OH-)
B. 0.1 mol/L的NaHCO3溶液中:c(Na+)=c(HCO![]() )+c(H2CO3)+2c(CO
)+c(H2CO3)+2c(CO![]() )
)
C. 将0.2 mol/L NaA溶液和0.1 mol/L盐酸等体积混合所得碱性溶液中:c(Na+)+c(H+)=c(A-)+c(Cl-)
D. 在25℃0.1 mol/L的 NH4Cl溶液中:c(Cl-)=c(NH![]() )+c(NH3·H2O)
)+c(NH3·H2O)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在 2 L的密闭容器中, 充入 1 mol N2 和 3 mol H2, 在一定的条件下反应, 2 分钟后达到平衡状态, 相同温度下, 测得平衡时混合气体的压强比反应前混合气体的压强减小了 1/10, 填写下列空白:
(1)平衡时混合气体中三种气体的物质的量比为 _________________
(2)N2 的转化率为 _______________
(3) 2分钟内, NH3 的平均反应速率为 ______________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com