
| A、MnO2 |
| B、WO3 |
| C、Fe3O4 |
| D、Cr2O3 |
科目:高中化学 来源: 题型:
| 编号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| A2B溶液的体积(mL) | 60 | 60 | 60 | 60 | 60 | 60 | 60 |
| CD2溶液的体积(mL) | 0 | 20 | 40 | 60 | 70 | 80 | 120 |
| 沉淀质量(g) | 0 | 0.464 | 1.395 | 1.404 | 1.397 |
查看答案和解析>>
科目:高中化学 来源: 题型:
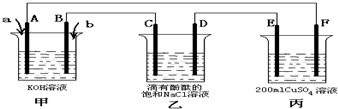
查看答案和解析>>
科目:高中化学 来源: 题型:
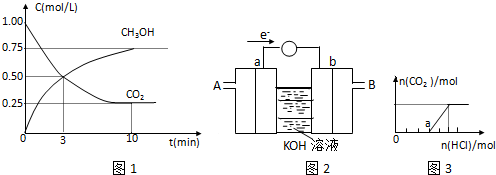
| n(CH3OH) |
| n(CO2) |
查看答案和解析>>
科目:高中化学 来源: 题型:
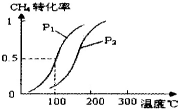 甲醇被称为2l世纪的新型燃料,请解决甲醇的有关问题.
甲醇被称为2l世纪的新型燃料,请解决甲醇的有关问题.| 实验编号 | T(℃) | n (CO)/n(H2) | P(MPa) | ||
| 1 | 150 |
| 0.1 | ||
| 2 |
| 5 | |||
| 3 | 350 | 5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
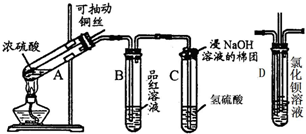 下列是与硫元素相关的一系列实验:根据下图所示实验回答下列问题:
下列是与硫元素相关的一系列实验:根据下图所示实验回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、酸性:HCN>HClO |
| B、浓度:c(CN-)<c(ClO-) |
| C、pH:HClO>HCN |
| D、与NaOH恰好完全反应时,消耗NaOH的物质的量:HClO>HCN |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

| H2O,H+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com