
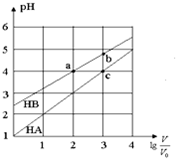
 常温下,浓度均为0.10mol/L、体积均为V0的HA和HB溶液,分别加水稀释至体积V,pH随$lg\frac{V}{V_0}$的变化如图所示,下列叙述正确的是( )
常温下,浓度均为0.10mol/L、体积均为V0的HA和HB溶液,分别加水稀释至体积V,pH随$lg\frac{V}{V_0}$的变化如图所示,下列叙述正确的是( )| A. | 该温度下HB的电离平衡常数约等于1.11×10-5 | |
| B. | 相同条件下NaA溶液的pH大于NaB溶液的pH | |
| C. | 溶液中水的电离程度:a=c>b | |
| D. | 当$lg\frac{V}{V_0}=3$时,若两溶液同时升高温度,则$\frac{{c({B^-})}}{{c({A^-})}}$减小 |
分析 0.1mol/L的HA溶液的pH=1,说明HA完全电离,所以HA为强酸,0.1mol/L的HB溶液的pH>2,说明HB在溶液中部分电离,所以HB是弱酸;
A.a点时,存在平衡:HB?H++B-,稀释100倍后,HB溶液的pH=4,溶液中c(A-)≈c(OH-)=10-4mol/L,结合Ka=$\frac{c({H}^{+})×c({B}^{-})}{c(HB)}$计算;
B.强酸强碱盐不水解,强碱弱酸盐水解显碱性;
C.酸抑制水的电离,酸电离出的氢离子浓度越大,对水的抑制程度越大;
D.升高温度促进弱酸的电离,酸根离子浓度增大,强酸的酸根离子浓度不变.
解答 解:0.1mol/L的HA溶液的pH=1,说明HA完全电离,所以HA为强酸,0.1mol/L的HB溶液的pH>2,说明HB在溶液中部分电离,所以HB是弱酸;
A.a点时,存在平衡:HB?H++B-,稀释100倍后,HB溶液的pH=4,溶液中c(A-)≈c(H+)=10-4mol/L,则Ka=$\frac{c({H}^{+})×c({B}^{-})}{c(HB)}$=$\frac{1{0}^{-4}×1{0}^{-4}}{0.001-1{0}^{-4}}$=1.11×10-5,故A正确;
B.HA为强酸,NaA是强酸强碱盐不水解,溶液显中性,NaB为强碱弱酸盐,水解显碱性,所以相同条件下NaA溶液的pH小于NaB溶液的pH,故B错误;
C.酸抑制水的电离,酸电离出的氢离子浓度越大,对水的抑制程度越大,氢离子浓度:a=c>b,所以溶液中水的电离程度:a=c<b,故C错误;
D.升高温度促进弱酸的电离,所以HB中B-浓度增大,强酸的酸根离子浓度不变,所以A-的浓度不变,因此$\frac{{c({B^-})}}{{c({A^-})}}$增大,故D错误.
故选A.
点评 本题考查弱电解质电离与影响因素、电离平衡常数、pH有关计算等,关键是根据pH的变化判断强弱电解质,注意理解电离平衡常数计算过程中的估算问题,题目难度中等.


科目:高中化学 来源: 题型:填空题
| 改变条件 | 平衡移动方向 | 体系内混合气体的颜色变化 |
| (1)加入氢气 | 正反应方向 | 变浅 |
| (2)升高温度 | 逆反应方向 | 变深 |
| (3)加入碘 | 正反应方向 | 变深 |
| (4)使容器的容积压缩到原来的一半 | 不移动 | 变深 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 合成顺丁橡胶(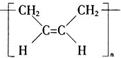 )的单体是CH2=CH-CH=CH2 )的单体是CH2=CH-CH=CH2 | |
| B. | 甲醇、乙二醇、丙三醇都为饱和醇,熔沸点依次递增 | |
| C. | 1mol 绿原酸  通过消去反应脱去1 molH2O时,能得到6 种不同产物(不考虑立体异构) 通过消去反应脱去1 molH2O时,能得到6 种不同产物(不考虑立体异构) | |
| D. | 0.1 mol的 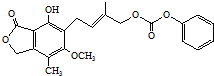 最多能与含0.5 molNaOH的水溶液完全反应 最多能与含0.5 molNaOH的水溶液完全反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
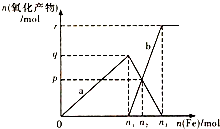 含有4molHNO3的稀硝酸分别与不同质量的铁粉反应,所得氧化产物a、b与铁粉物质的量关系如图所示.下列有关判断不正确的是( )
含有4molHNO3的稀硝酸分别与不同质量的铁粉反应,所得氧化产物a、b与铁粉物质的量关系如图所示.下列有关判断不正确的是( )| A. | a是Fe(NO3)3 | B. | n1=1 | C. | p=1.2 | D. | n3=1.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 25℃时,50 g 98%浓硫酸和50 g 98%浓磷酸混合后含氧原子数为4NA | |
| B. | 28 g聚乙烯中含有的碳原子数为2n NA | |
| C. | 常温常压下,0.2 g D216O中含有的质子数、中子数和电子数均为0.1NA | |
| D. | 6.8 g KHSO4晶体中含有0.1 NA个阳离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
| 离子 | Fe2+ | Cu2+ | Mg2+ |
| pH | 7.6 | 5.2 | 10.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 3 | B. | 4 | C. | 5 | D. | 6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 温度/℃ | 起始物成质的量/mol | 平衡物质的两/mol | |||
| 容器编马 | CO | Cl2 | COCl2 | COCl2 | |
| Ⅰ | 500 | 1.0 | 1.0 | 0 | 0.8 |
| Ⅱ | 500 | 1.0 | a | 0 | 0.5 |
| Ⅲ | 600 | 0.5 | 0.5 | 0.5 | 07 |
| A. | 容器I中前5min的平均反应速率v(CO)=0.16mol•L-1•min-1 | |
| B. | 该反应正反应为吸热反应 | |
| C. | 容器Ⅱ中起始时Cl2的物质的量为0.55mol | |
| D. | 若起始时向容器I加入CO0.8mol,Cl20.8mol,达到平衡时CO转化率大于80%. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
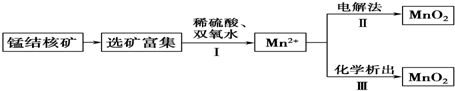
| A. | 反应Ⅰ的离子方程式为MnO2+H2O2+2H+═Mn2++2H2O+O2↑ | |
| B. | 反应Ⅱ中阴极反应式为Mn2+-2e-+2H2O═MnO2↓+4H+ | |
| C. | 若加入KClO3,则反应Ⅲ为2ClO3-+5Mn2++4H2O═5MnO2↓+Cl2↑+8H+ | |
| D. | 若加入KMnO4,则反应Ⅲ为3Mn2++2MnO4-+2H2O═5MnO2↓+4H+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com