
| A. | 蓄电池放电时,每消耗0.1molPbO2,则共生成0.1molPbSO4 | |
| B. | 电解硫酸钠溶液时的阳极反应式为4OH--4e=2H2O+O2↑ | |
| C. | 电解一段时间后若硫酸钠溶液中没有晶体析出则c(Na2SO4)不变 | |
| D. | 蓄电池放电一段时间后其电解液中H2SO4的浓度、密度都变大 |
分析 放电时,电池反应式为PbO2+Pb+2H2SO4$?_{充电}^{放电}$2PbSO4+2H2O,放电时,Pb为负极,被氧化生成PbSO4,电极反应式为Pb-2e-+SO42-=PbSO4,正极反应为PbO2+2e+4H++SO42-=PbSO4+2H2O,充电为放电的逆反应,电解硫酸钠溶液实际上是电解水,据此分析.
解答 解:A.蓄电池放电时,每消耗0.1molPbO2,则共生成0.2molPbSO4,故A错误;
B.电解硫酸钠溶液时,阳极上氢氧根离子失电子生成氧气,则阳极的反应式为4OH--4e=2H2O+O2↑,故B正确;
C.电解硫酸钠溶液实际上是电解水,水的质量减小,溶液的体积减小,则c(Na2SO4)增大,故C错误;
D.根据蓄电池放电时的反应可知,放电时消耗硫酸,则放电时电解液中H2SO4的浓度减小,溶液的密度减小,故D错误.
故选B.
点评 本题考查铅蓄电池,题目难度不大,注意电池的总反应式和电极反应式的书写,注意放电时溶液中硫酸浓度的变化.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
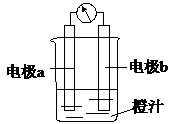 课堂学习中,同学们利用镁条、锌片、铜片、导线、电流计、橙汁、烧杯等用品探究原电池的组成.下列结论不正确的是( )
课堂学习中,同学们利用镁条、锌片、铜片、导线、电流计、橙汁、烧杯等用品探究原电池的组成.下列结论不正确的是( )| A. | 原电池是将化学能转化成电能的装置 | |
| B. | 原电池由电极、电解质溶液和导线等组成 | |
| C. | 右图中a极为镁条、b极为锌片时,导线中会产生电流 | |
| D. | 右图中a极为锌片、b极为铜片时,电子由铜片通过导线流向锌片 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化硅是制造光电池的主要原料 | |
| B. | 硅是现代光学及光纤制品的基本原料 | |
| C. | 可用石英坩埚加热氢氧化钠固体 | |
| D. | 在电子工业中,硅是重要的半导体材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
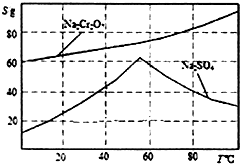 实验室模拟用铬铁矿(主要成分是FeO•Cr2O3)制备红矾钠(Na2Cr2O7•2H20).
实验室模拟用铬铁矿(主要成分是FeO•Cr2O3)制备红矾钠(Na2Cr2O7•2H20).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝、氧化铝中铝元素微粒的半径r(Al3+)<r(Al) | |
| B. | 工业上可用铝热反应的方法提取镁 | |
| C. | 在铝热反应中化学能全部转化为光能 | |
| D. | 在铝热反应中铁的还原性大于铝的还原性 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解过程中,Na+和SO42-的物质的量浓度保持不变 | |
| B. | 电解过程中,溶液颜色呈现红色→紫色→蓝色的变化 | |
| C. | 阴极产生的气体自始至终只有H2 | |
| D. | 第一阶段中阴、阳两极产生的气体混合引燃后,恰好完全反应得到HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe粉中混有Zn粉杂质(稀H2SO4) | B. | FeCl3溶液中混有FeCl2杂质(Cl2) | ||
| C. | NaCl固体中混有I2杂质(加热) | D. | SiO2中混有CaCO3杂质(盐酸) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com