
【题目】下列指定反应的离子方程式正确的是
A. Ca(ClO)2溶液中通入少量SO2:Ca2++2ClO-+SO2+H2O=CaSO4↓+H++Cl-+ HClO
B. 向FeCl2溶液加入足量NaClO溶液:6Fe2++3ClO-+3H2O=2Fe(OH)3↓+4Fe3++3Cl-
C. NH4HCO3溶液和过量的NaOH溶液混合:HCO![]() +OH-===CO
+OH-===CO![]() +H2O
+H2O
D. 向Fe(NO3)3溶液中加入足量的HI溶液:2Fe3++2I-= 2Fe2++I2
科目:高中化学 来源: 题型:
【题目】下列化学用语正确的是( )
A. 重水的分子式:D2OB. 次氯酸的结构式:H—Cl—O
C. 乙烯的实验式:C2H4D. 二氧化硅的分子式:SiO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氯甲烷又称氯仿,是一种无色透明液体,易挥发,有香气,略有甜味,不易燃烧,但在常温下与空气直接接触,易被氧化,并生成剧毒物光气,常用作有机溶剂和麻醉剂,结构简式为CHCl3。实验室中可用热还原CCl4法制备氯仿,装置示意图及有关数据如下:
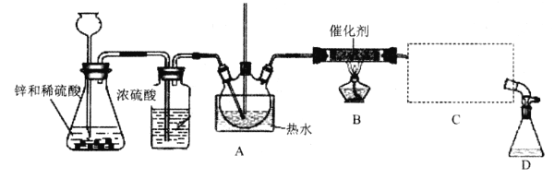
物质 | 相对分子质量 | 密度/(g/Ml) | 沸点/℃ | 水中溶解性 |
CHCl3 | 119.5 | 1.50 | 61.3 | 难溶 |
CCl4 | 154 | 159 | 76.7 | 难溶 |
实验步骤:
① ;
② 向三颈瓶中滴入20mL CCl4;
③ 开始通入H2;
④ 向A处水槽中加入热水,并接通C处冷凝装置的冷水;
⑤ 点燃B处酒精灯;
⑥ 反应结束后,停止加热,将D处锥形瓶中收集到的液体分别用适量NaHCO3溶液和水洗涤,分出的产物加人少量无水CaCl2固体,静置后过滤;
⑦ 对滤液进行蒸馏纯化,得到氯仿15g。请回答:
(1) A中长直玻璃管的作用为_____;①处的操作为_______。
(2) B处中发生主要反应的化学方程式为___________。
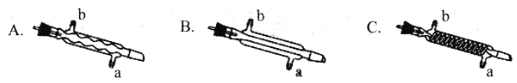
(3) C处中应选用的冷凝管为____(填选项字母);冷水应从该冷凝管的____(填“a”或 “b”)口接入。
(4)该实验中,氯仿的产率为_______。
(5)氯仿在空气中能被氧气氧化生成HCl和光气(COCl2),该反应的化学方程式为_____.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四种短周期元素A、B、C、D的性质或结构信息如下:
信息:①原子半径:A>B>C>D②四种元素之间形成的某三种分子的比例模型及部分性质如下:
甲: ![]() 是地球上最常见的物质之一,是所有生命体生存的重要资源,约占人体体重的三分之二.
是地球上最常见的物质之一,是所有生命体生存的重要资源,约占人体体重的三分之二.
乙: ![]() 无色,无气味并且易燃.是常见的一种基础能源.
无色,无气味并且易燃.是常见的一种基础能源.
丙: ![]() 有强氧化性的弱酸,可以用于消毒杀菌.
有强氧化性的弱酸,可以用于消毒杀菌.
请根据上述信息回答下列问题.
(1)B元素在元素周期表中的位置为 , 请写出BC2分子的电子式: .
(2)A所在周期中,E元素的单质还原性最强,F元素的某些盐类常用作净水剂.E单质与甲反应有化合物X生成.请写出以下两个反应的离子方程式:
①A元素的单质与物质甲发生反应: .
②F、C两种元素组成的化合物Y可作为高温结构陶瓷材料,X与Y两种化合物在溶液中发生反应: .
(3)物质丁的元素组成和甲相同,丁分子具有18电子结构.向盛有一定浓度丁溶液的试管中,逐滴加入硫酸酸化的硫酸亚铁溶液.滴加过程中的现象为:
①试管中溶液变成深棕黄色,发生反应的离子方程式为;
②开始有少量气泡出现(经验证是氧气),片刻后反应变得剧烈,继续滴加溶液,静置一段时间,试管底部出现红褐色沉淀.请回答“片刻后反应变得剧烈”的原因是ab .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】c(OH-)相同的氢氧化钠溶液和氨水,分别用蒸馏水稀释至原体积的m倍和n倍,若稀释后两溶液的c(OH-)仍相同,则m和n的关系是( )
A.m>nB.m=nC.m<nD.不能确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是模拟电化学反应的装置图,有关叙述正确的是

A. X为碳棒,Y为NaCl溶液,开关C置于A处,铁棒表面 产生气体
B. X为铜棒,Y为CuSO4溶液,开关C置于B处,铁棒质量将减小,溶液中Cu2+浓度也减小
C. X为碳棒,Y为NaCl溶液,开关C置于B处,电子由负极流到铁片,再由铁片通过溶液流到碳棒,最后流回正极
D. X为锌片,Y为NaCl溶液,开关C置于A处,铁氧化速率增加
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(8分)原子序数11~17的元素,自钠到氯,电子层数相同,最外层电子数从 增加到 ,随着核电荷数依次递增,原子半径依次 ,核对外层电子的引力逐渐 ,失电子能力逐渐 ,得电子能力逐渐 ,因此,金属性逐渐 ,非金属性逐渐 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随原子序数的递增,八种短周期元素(用字母X表示)原子半径的相对大小、最高正价或最低负价的变化如下图所示。
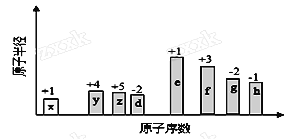
根据判断出的元素回答问题:
(1)f在元素周期表的位置是__________。
(2)比较d、e常见离子的半径的大小(用化学式表示,下同)_______>__________;比较g、h的最高价氧化物对应的水化物的酸性强弱是:_______>__________。
(3)任选上述元素组成一种四原子共价化合物,写出其电子式__________。
(4)已知1mole的单质在足量d2中燃烧,恢复至室温,放出255.5kJ热量,写出该反应的热化学方程式:___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【黑龙江省双鸭山市第一中学2017届高三全真模拟(第四次)考试理科综】化学是你,化学是我,化学深入我们的生活。下列说法正确的是( )
A. 常温下,纯水的电离度为10-7×100%
B. 不能用溴水区分生物柴油和汽油
C. 海水淡化可使用冷冻法、离子交换法、电解法、反渗透法、明矾吸附法
D. 开发可燃冰,有利于节省化石燃料,并减少温室效应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com