
常温下,相同pH的氢氧化钠和醋酸钠溶液分别加水稀释,平衡时pH随溶液体积变化的曲线如下图所示,则下列叙述正确的是
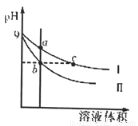
A.b、c两点溶液的导电能力相同
B.a、b、c三点溶液中水的电离程度a>c>b
C.c点溶液中c(H+)=c(OH-)+c(CH3COOH)
D.用等浓度的盐酸分别与等体积的b,c处溶液恰好完全反应,消耗盐酸体积Vb=Vc
 通城学典默写能手系列答案
通城学典默写能手系列答案科目:高中化学 来源:2016-2017年新疆兵团第二师华山中学高二上学前考化学卷(解析版) 题型:选择题
同周期的X、Y、Z三种元素,已知其最高价氧化物对应的水化物的酸性强弱顺序是:[HXO4>H2YO4>H3ZO4,则下列各判断中正确的是
A. 原子半径:X>Y>Z B. 单质的非金属性:X>Y>Z
C. 气态氢化物稳定性:X<Y<Z D. 原子序数:X<Y<Z
查看答案和解析>>
科目:高中化学 来源:2016-2017学年辽宁省高一上开学考化学卷(解析版) 题型:选择题
化学实验中常涉及实验操作的先后顺序,下列实验操作不正确的是
A.制取二氧化碳时,先检查装置的气密性,后装药品
B.氢气还原氧化铜时,先通一会氢气,后加热氧化铜
C.给试管中的物质加热时,先均匀加热,后集中在药品的部位加热
D.用排水法收集氧气时,先撤酒精灯,后撤导气管
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江大庆实验中学高一上开学考化学卷(解析版) 题型:选择题
除去下列物质中混有的少量杂质,所用除杂试剂及操作方法均正确的是( )
选项 | 物质 | 杂质 | 除杂试剂及操作方法 |
A | FeCl2溶液 | CuCl2溶液 | 加入过量铁粉,充分反应后过滤 |
B | KCl固体 | MnO2固体 | 加足量的水溶解、过滤、洗涤、干燥 |
C | CaO | CaCO3 | 加入适量的稀盐酸至不再生产气体为止 |
D | Cu | C | 在空气中灼烧 |
查看答案和解析>>
科目:高中化学 来源:2017届安徽省高三上学期第一次月考化学试卷(解析版) 题型:填空题
雾霾由多种污染物形成,其中包含颗粒物(包括PM2.5在内)、氮氧化物(NOx)、CO、SO2等。化学在解决雾霾污染中有着重要的作用。回答下列问题:
(1)已知:2SO2(g)+O2(g) 2SO3(g) ΔH=-196.6 kJ·mol -1
2SO3(g) ΔH=-196.6 kJ·mol -1
2NO(g)+O2(g) 2NO2(g) ΔH=-113.0 kJ·mol-1
2NO2(g) ΔH=-113.0 kJ·mol-1
则反应NO2(g)+SO2(g) SO3(g)+NO(g) 的ΔH= kJ·mol-1。
SO3(g)+NO(g) 的ΔH= kJ·mol-1。
一定条件下,将NO2与SO2以体积比1:2置于恒温恒容的密闭容器中发生上述反应,下列能说反应达到平衡状态的有 。(填字母)
a.体系密度保持不变 b.混合气体颜色保持不变
c.SO3和NO的体积比保持不变 d.每消耗1 mol SO3的同时生成1 mol NO2
测得上述反应平衡时NO2与SO2体积比为1:5,则平衡常数K= 。
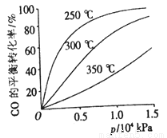
(2)CO可用于合成甲醇,反应的化学方程式为 CO(g)+2H2(g) CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如下图所示。实际生产条件控制在250℃、1.3×104kPa左右,选择此压强的理由是 。
CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如下图所示。实际生产条件控制在250℃、1.3×104kPa左右,选择此压强的理由是 。
(3)一种用NH3脱除烟气中NO的原理如下图:

①该脱硝原理中,NO最终转化为H2O和 (填化学式)。
②当消耗1 mol NH3和0.5 molO2时,除去的NO在标准状况下的体积为 。
(4)NO直接催化分解(生成N2和O2)也是一种脱硝途径。在不同条件下,NO的分解产物不同。在高压下,NO在40℃下分解生成两种化合物,反应物与生成物三者的物质的量之比比3:1:1,则该反应的化学方程式为 。
查看答案和解析>>
科目:高中化学 来源:2017届安徽省高三上学期第一次月考化学试卷(解析版) 题型:选择题
下列根据实验操作和实验现象所得出的结论,正确的是
选项 | 实验操作 | 实验现象 | 结论 |
A | 向两份蛋白质溶液中分别滴加饱和Na2SO4溶液和CuSO4溶液 | 均有固体析出 | 蛋白质均发生变性 |
B | 在CuSO4溶液中加入KI溶液,再加入苯,振荡后静置 | 有白色沉淀生成,苯层呈紫红色 | 白色沉淀可能为CuI |
C | 将气体X通入品红溶液中 | 红色褪去 | X一定是SO2 |
D | 将Fe(NO3)2样品溶于稀H2SO4后,滴加KSCN溶液 | 溶液变为血红色 | Fe(NO3)2样品已氧化变质 |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山西省高二上开学考化学试卷(解析版) 题型:填空题
碳是形成化合物种类最多的元素,其单质及化合物是人类生产生活的主要能源物质。请回答下列问题:
(1)有机物M经过太阳光光照可转化成N,转化过程如下:
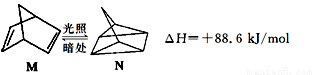
则M、N相比,较稳定的是 。
(2)已知CH3OH(l)的燃烧热为726.5kJ·mol-1,CH3OH(l) + 1/2O2(g) ═ CO2(g) + 2H2(g) △H=-a kJ·mol-1,则a 726.5(填“>”、“<”或“=”)。
(3)使Cl2和H2O(g)通过灼热的炭层,生成HCl和CO2,当有1mol Cl2参与反应时释放出145kJ热量,写出该反应的热化学方程式 。
(4)火箭和导弹表面的薄层是耐高温物质。将石墨、铝粉和二氧化钛按一定比例混合在高温下煅烧,所得物质可作耐高温材料,4Al(s)+3TiO2(s)+3C(s)═2Al2O3(s)+3TiC(s) △H=-1176kJ·mol-1,则反应过程中,每转移1mol电子放出的热量为 。
(5)已知:Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g) △H=+489.0 kJ·mol-1
CO(g)+1/2O2(g)=CO2(g) △H=-283.0kJ·mol-1
C(石墨)+O2(g)=CO2(g) △H=-393.5kJ·mol-1
则4Fe(s)+3O2(g)=2Fe2O3(s) △H= 。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山西省高二上开学考化学试卷(解析版) 题型:选择题
下面是几种常见的化学电源示意图,有关说法不正确的是
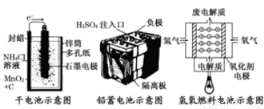
A.上述电池分别属于一次电池、二次电池和燃料电池
B.干电池在长时间使用后,锌筒被破坏
C.铅蓄电池工作过程中,每通过2mol电子,负极质量减轻207g
D.氢氧燃料电池是一种具有应用前景的绿色电源
查看答案和解析>>
科目:高中化学 来源:2017届广西省高三上8月月考理综化学试卷(解析版) 题型:实验题
焦亚硫酸钠(Na2S2O3)是常用的食品抗氧化剂之一,在空气中被氧化生成的产物为Na2SO4.某小组进行如下实验:
实验一 焦亚硫酸钠的制取
采用下图装置(实验前已除尽装置内的空气)制取Na2S2O5。装置II中有Na2S2O5晶体析出,发生的反应为:Na2SO3+SO2=Na2S2O5
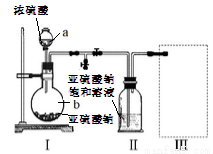
(1)仪器a、b的名称分别是_________、__________。
(2)装置I中产生气体的化学方程式为__________。
(3)要从装置II中获得已析出的晶体,可采用的分离方法是__________,该方法用到的玻璃仪器除烧杯、漏斗还需___________。
(4)装置III用于处理尾气,可选用的最合理装置(夹持仪器已略去)为_________(填序号)。
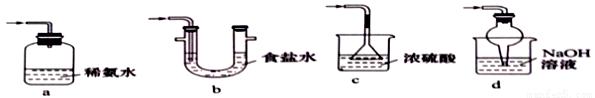
实验二 焦亚硫酸钠的性质
Na2S2O5溶于水即生成NaHSO3
(5)NaHSO3溶液中HSO3-的电离程度大于水解程度,可采用的实验方法是_________(填序号)。
A.测定溶液的pH
B.加入Ba(OH)2溶液
C.加入盐酸
D.加入品红溶液
E.用蓝色石蕊试纸检测
(6)检验Na2S2O5晶体在空气中已被氧化的实验方案是________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com