
下列离子方程式书写正确的是( )
|
| A. | 稀硫酸跟铁反应:Fe+6H+=2Fe3++3H2↑ |
|
| B. | 稀硫酸与氢氧化钡溶液反应:H++OH﹣=H2O |
|
| C. | 碳酸钙放入稀盐酸中:CO32+2H+=CO2↑+H2O |
|
| D. | 稀盐酸放入碳酸钠中:CO32+2H+=CO2↑+H2O |
考点:
离子方程式的书写.
专题:
离子反应专题.
分析:
A.反应生成硫酸亚铁和氢气;
B.漏写生成硫酸钡的离子反应;
C.碳酸钙在离子反应中保留化学式;
D.反应生成氯化钠、水和二氧化碳.
解答:
解:A.稀硫酸跟铁反应的离子反应为Fe+2H+=Fe2++H2↑,故A错误;
B.稀硫酸与氢氧化钡溶液反应的离子反应为2H++2OH﹣+Ba2++SO42﹣=BaSO4↓+2H2O,故B错误;
C.碳酸钙放入稀盐酸中的离子反应为CaCO3+2H+=CO2↑+H2O+Ca2+,故C错误;
D.稀盐酸放入碳酸钠中的离子反应为CO32+2H+=CO2↑+H2O,故D正确;
故选D.
点评:
本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重复分解反应、置换反应的离子反应考查,题目难度不大.


 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案科目:高中化学 来源: 题型:
右表为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是( )
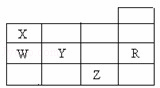
|
| A. | 常压下五种元素的单质中,Z单质的沸点最高 |
|
| B. | Y、Z的阴离子电子层结构都与R原子的相同 |
|
| C. | W的氢化物的沸点比X的氢化物的沸点高 |
|
| D. | Y元素的非金属性比W元素的非金属性强 |
查看答案和解析>>
科目:高中化学 来源: 题型:
表是元素周期表的一部分.表中所列的字母分别代表一种化学元素.

试回答下列问题(凡涉及的物质均用化学式表示):
(1)a的氢化物的分子构型为 ,中心原子的杂化形式为 ;d的最高价氧化物的分子构型为 ,中心原子的杂化形 ,该分子是 (填“极性”或“非极性”)分子.
(2)b、d、e三种元素的氢化物中的沸点最高的是 ,原因是: .
(3)将g的无水硫酸盐溶解于水中,溶液呈蓝色,是因为生成了一种呈蓝色的配合离子,写出该配合离子的结构简式(必须将配位键表示出来) .
(4)f(NH3)5BrSO4可形成两种配合物,已知f3+的配位数是6,为确定f的配合物的结构,现对两种配合物进行如下实验:在第一种配合物的溶液中加BaCl2 溶液时,产生白色沉淀,在第二种配合物溶液中加入BaCl2溶液时,则无明显现象,第二种配合物的化学式为 ,该配合物的配体是 、 ;
(5)c单质晶体中原子的堆积方式如图甲所示,其晶胞特征如图乙所示,原子之间相互位置关系的平面图如图丙所示.
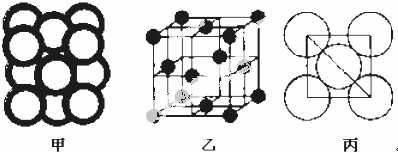
c单质晶体中原子的配位数为 .若已知c的原子半径为r,NA代表阿伏加德罗常数,c的相对原子质量为M.该晶体的密度为 (用字母表示).
查看答案和解析>>
科目:高中化学 来源: 题型:
Na2CO3俗名纯碱,下列对Na2CO3采用不同分类法的分类.不正确的是( )
|
| A. | Na2CO3是碱 | B. | Na2CO3是盐 | C. | Na2CO3是正盐 | D. | Na2CO3是钠盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:
1.00L 1.00mol•L﹣1 NaOH溶液与足量的稀盐酸反应,放出 57.4kJ的热量.表示该反应的中和热的热化学方程式正确的是( )
|
| A. | NaOH+HCl═NaCl+H2O△H=+57.4kJ•mol﹣1 |
|
| B. | NaOH+HCl═NaCl+H2O△H=﹣57.4 kJ•mol﹣1 |
|
| C. | NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)△H=+57.4 kJ•mol﹣1 |
|
| D. | NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)△H=﹣57.4 kJ•mol﹣1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com