
分析 (1)在阳离子中,质量数=质子数+中子数;核电荷数=质子数=核外电子数+所带电荷数;
(2)根据元素的种类由质子数决定分析,根据质子数、中子数和核数、同位素的概念判断,同位素最外层电子数相同;
(3)距离原子核越远,能层能量越高能量越高,Mg原子核外电子排到M层.
解答 解:(1)因2311Na+的质子数为11,质量数为23,中子数=质量数-质子数=23-11=12,核外电子数=质子数-所带电荷数=11-1=10,故答案为:11;12;10;
(2)元素就是具有相同的核电荷数(即核内质子数)的一类原子的总称,不同种元素最本质的区别是质子数不同,元素的种类由质子数决定,11H、12H、13H的质子数都是1,所以3种不同粒子${\;}_{1}^{1}$H、${\;}_{1}^{2}$H、${\;}_{1}^{3}$H表示同一种元素氢元素;
核素是指具有一定数目质子和一定数目中子的一种原子;11H、12H、13H的质子数都是1,中子数分别为0、1、2,属于三种核数;
具有相同质子数,不同中子数同一元素的不同核素互为同位素;11H、12H、13H的质子数都是1,中子数分别为0、1、2,属于同位素;
同位素最外层电子数相同,化学性质相同,故答案为:1;3;同位素;相同;
(3)2412Mg的电子数为12,核外电子排布为1s22s22p63s2,距离原子核越远,能层能量越高,因此能量最高的为M层,故答案为:M.
点评 本题考查原子的表示式、核素、同位素、质量数A=质子数Z+中子数N的计算和核外电子排布规律,解答此类题,除了解核组成符号外,还要记住两个关系:A═Z+N,质子数═核外电子数═原子序数═质量数-中子数.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③⑤ | B. | ①③⑤ | C. | ①④⑤ | D. | ②④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | υD=0.4mol/(L•s) | B. | υC=0.5mol/(L•s) | C. | υB=0.6mol/(L•s) | D. | υA=0.22mol/(L•s) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
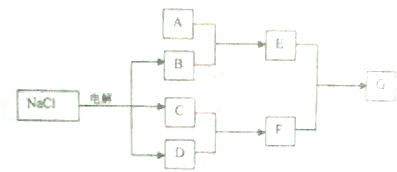
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

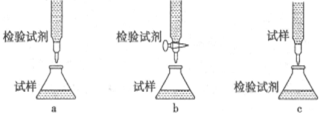
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com