
A.KOH多于![]()
B.KOH等于![]()
C.KOH与![]() 任意比
任意比
D.KOH少于![]()
 导学教程高中新课标系列答案
导学教程高中新课标系列答案科目:高中化学 来源: 题型:
(10分)
草酸(H2C2O4)是一种重要的化工原料。已知常温下0.01 mol·L-1的H2C2O4、KHC2O4、K2C2O4溶液的pH如下表所示。
| H2C2O4 | KHC2O4 | K2C2O4 | |
| pH | 2.0 | 3.1 | 8.1 、 |
(1)在其它条件不变时,下列措施能使KHC2O4溶液中c(K+)∶c(HC2O4-)接近1∶1的是_________(填字母)。
A.加入适量的H2C2O4 B.加入适量的KHC2O4
C.加入适量的Na2C2O4 D.升高溶液的温度
(2)取一定质量H2C2O4·2H2O和KHC2O4的混合物,加水溶解,配成250 mL溶液,取两份此溶液各25 mL,向第一份溶液中先加入几滴酚酞试液,再滴加0.25 mol·L-1 NaOH溶液至20.00 mL时,溶液由无色变为浅红色;向第二份溶液中滴加适量3mol·L-1 H2SO4溶液酸化后,用0.10mol·L-1KMnO4溶液滴定,当消耗KMnO4溶液16.00 mL时,溶液由无色变为浅紫红色。请回答下列问题:
①完成离子方程式:5C2O42-+2Mn04-+16H+ =10______+2Mn2++8H2O。
②原混合物中H2C2O4·2H2O和KHC2O4的物质的量之比为__________。
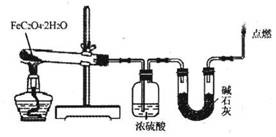
(3)某实验小组用如图所示的装置探究FeC2O4·2H2O在隔绝空气条件下受热分解的产物。当36.0g FeC2O4·2H2O充分反应后,残留固体质量为13.6g,浓硫酸增重7.2g,碱石灰增重11.0g。求残留固体的成分和物质的量。(已知FeC2O4·2H2O的相对分子质量为180;设反应产生的气体被充分吸收)

查看答案和解析>>
科目:高中化学 来源: 题型:
草酸(H2C2O4)是一种重要的化工原料。已知常温下0.01 mol·L-1的H2C2O4、KHC2O4、K2C2O4溶液的pH如下表所示。
|
| H2C2O4 | KHC2O4 | K2C2O4 |
| pH | 2.0 | 3.1 | 8.1 、 |
(1)在其它条件不变时,下列措施能使KHC2O4溶液中c(K+)∶c(HC2O4-)接近1∶1的是_________(填字母)。
A.加入适量的H2C2O4 B.加入适量的KHC2O4
C.加入适量的Na2C2O4 D.升高溶液的温度
(2)取一定质量H2C2O4·2H2O和KHC2O4的混合物,加水溶解,配成250 mL溶液,取两份此溶液各25 mL,向第一份溶液中先加入几滴酚酞试液,再滴加0.25 mol·L-1NaOH溶液至20.00 mL时,溶液由无色变为浅红色;向第二份溶液中滴加适量3mol·L-1 H2SO4溶液酸化后,用0.10mol·L-1KMnO4溶液滴定,当消耗KMnO4溶液16.00 mL时,溶液由无色变为浅紫红色。请回答下列问题:
①完成离子方程式:5C2O42-+2Mn04-+16H+=10______+2Mn2++8H2O。
②原混合物中H2C2O4·2H2O和KHC2O4的物质的量之比为__________。
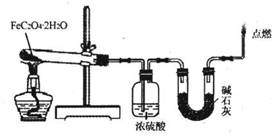
(3)某实验小组用如图所示的装置探究FeC2O4·2H2O在隔绝空气条件下受热分解的产物。当36.0g FeC2O4·2H2O充分反应后,残留固体质量为13.6g,浓硫酸增重7.2g,碱石灰增重11.0g。求残留固体的成分和物质的量。(已知FeC2O4·2H2O的相对分子质量为180;设反应产生的气体被充分吸收)

查看答案和解析>>
科目:高中化学 来源: 题型:
草酸(H2C204)是一种重要的化工原料。已知常温下0.01 mol·L-l的H2C204、KHC204、K2C204溶液的pH如下表所示。 。.
|
| H2C204 | KHC204 | K2C204 |
| pH | 2.0 | 3.1 | 8.1 、 |
(1)在其它条件不变时,下列措施能使KHC204溶液中c(K+):c(HC204-)接近1:1的是_________(填字母)。
A.加入适量的H2C204 B.加入适量的KHC204
C.加入适量的Na2C204 D.升高溶液的温度
(2)取一定质量H2C204·2H20和KHC204的混合物,加水溶解,配成250 mL溶液,取两份此溶液各25 mL,向第一份溶液中先加入几滴酚酞试液,再滴加0.25 mol·L-l NaOH溶液至20.00 mL时,溶液由无色变为浅红色;向第二份溶液中滴加适量3 mol·L-l H2S04溶液酸化后,用0.10 mol·L-l KMnO4溶液滴定,当消耗KMnO4溶液16.00 mL时,溶液由无色变为浅紫红色。请回答下列问题:
①完成离子方程式:5C2042-+2Mn04-+16H+=10______+2Mn2++8H2O。
②原混合物中H2C204·2H20和KHC204的物质的量之比为__________。
(3)某实验小组用如图所示的装置探究FeC204·2H20在隔绝空气条件下受热分解的产物。当36.0g FeC204·2H20充分反应后,残留固体质量为13.6g,浓硫酸增重7.2g,碱石灰增重11.0g。求残留固体的成分和物质的量。(已知FeC204·2H20的相对分子质量为180;设反应产生的气体被充分吸收)

查看答案和解析>>
科目:高中化学 来源:江苏省苏北四市2010届高三第二次模拟考试 题型:填空题
草酸(H2C2O4)是一种重要的化工原料。已知常温下0.01 mol·L-1的H2C2O4、KHC2O4、K2C2O4溶液的pH如下表所示。
|
|
H2C2O4 |
KHC2O4 |
K2C2O4 |
|
pH |
2.0 |
3.1 |
8.1 、 |
(1)在其它条件不变时,下列措施能使KHC2O4溶液中c(K+)∶c(HC2O4-)接近1∶1的是_________(填字母)。
A.加入适量的H2C2O4 B.加入适量的KHC2O4
C.加入适量的Na2C2O4 D.升高溶液的温度
(2)取一定质量H2C2O4·2H2O和KHC2O4的混合物,加水溶解,配成250 mL溶液,取两份此溶液各25 mL,向第一份溶液中先加入几滴酚酞试液,再滴加0.25 mol·L-1 NaOH溶液至20.00 mL时,溶液由无色变为浅红色;向第二份溶液中滴加适量3mol·L-1 H2SO4溶液酸化后,用0.10mol·L-1KMnO4溶液滴定,当消耗KMnO4溶液16.00 mL时,溶液由无色变为浅紫红色。请回答下列问题:
①完成离子方程式:5C2O42-+2Mn04-+16H+ =10______+2Mn2++8H2O。
②原混合物中H2C2O4·2H2O和KHC2O4的物质的量之比为__________。
(3)某实验小组用如图所示的装置探究FeC2O4·2H2O在隔绝空气条件下受热分解的产物。当36.0g FeC2O4·2H2O充分反应后,残留固体质量为13.6g,浓硫酸增重7.2g,碱石灰增重11.0g。求残留固体的成分和物质的量。(已知FeC2O4·2H2O的相对分子质量为180;设反应产生的气体被充分吸收)
查看答案和解析>>
科目:高中化学 来源:苏北四市2010届高三第二次调研考试 题型:填空题
草酸(H2C204)是一种重要的化工原料。已知常温下0.01 mol·L-l的H2C204、KHC204、K2C204溶液的pH如下表所示。 。.
|
|
H2C204 |
KHC204 |
K2C204 |
|
pH |
2.0 |
3.1 |
8.1 、 |
(1)在其它条件不变时,下列措施能使KHC204溶液中c(K+):c(HC204-)接近1:1的是_________(填字母)。
A.加入适量的H2C204 B.加入适量的KHC204
C.加入适量的Na2C204 D.升高溶液的温度
(2)取一定质量H2C204·2H20和KHC204的混合物,加水溶解,配成250 mL溶液,取两份此溶液各25 mL,向第一份溶液中先加入几滴酚酞试液,再滴加0.25 mol·L-l NaOH溶液至20.00 mL时,溶液由无色变为浅红色;向第二份溶液中滴加适量3 mol·L-l H2S04溶液酸化后,用0.10 mol·L-l KMnO4溶液滴定,当消耗KMnO4溶液16.00 mL时,溶液由无色变为浅紫红色。请回答下列问题:
①完成离子方程式:5C2042-+2Mn04-+16H+ =10______+2Mn2++8H2O。
②原混合物中H2C204·2H20和KHC204的物质的量之比为__________。
(3)某实验小组用如图所示的装置探究FeC204·2H20在隔绝空气条件下受热分解的产物。当36.0g FeC204·2H20充分反应后,残留固体质量为13.6g,浓硫酸增重7.2g,碱石灰增重11.0g。求残留固体的成分和物质的量。(已知FeC204·2H20的相对分子质量为180;设反应产生的气体被充分吸收)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com