
【题目】相同温度下,在体积相等的三个恒容器闭容器中发生可逆反应:2NH3(g)![]() N2(g)+3H3(g) ΔH=+92.4 kJ/mol。
N2(g)+3H3(g) ΔH=+92.4 kJ/mol。
实验测得起始、平衡时的有关数据如下表:
容器 编号 | 起始时各物质物质的量/mol | 平衡时反应中 的能量变化 | ||
NH3 | N2 | H2 | ||
① | 2 | 0 | 0 | 吸收热量a kJ |
② | 0 | 1 | 3 | 放出热量b kJ |
③ | 4 | 0 | 0 | 吸收热量c kJ |
下列叙述正确的是( )
A.热量关系:a=b
B.①②③反应的平衡常数:③>①>②
C.达平衡时H2的体积分数:①>③
D.①中的密度不再改变时说明反应已达到平衡状态
【答案】C
【解析】若反应①中NH3的平衡转化率为50%,则a=b,若反应①中NH3的平衡转化率小于50%,则a<b,若反应①中NH3的平衡转化率大于50%,则a>b,A选项错误;温度相同,所以反应①、②、③的平衡常数相同,B选择错误;反应③可以看成是在两个相同容器中相同条件下同时进行反应①,达平衡后,把这两个容器中的气体压缩到其中一个容器中,如果平衡不移动,氢气的体积分数应该与反应①相等,但是压强增大,平衡向逆反应方向移动,氢气的体积分数减小,所以达平衡时氢气的体积分数:①>③,C选项正确;因为气体总质量始终不变,容器恒容,所以密度始终不变,不能用密度变化来衡量反应是否达到平衡状态,D选项错误。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】将等物质的量的A、B混合于2L的密闭容器中发生如下反应:3A(g)+B(g) ![]() xC(g)+2D(g),经5min后测得D的浓度为0.5mol/L,c(A):c(B)=3:5,C的平均反应速率是0.1 mol/(L·min)。
xC(g)+2D(g),经5min后测得D的浓度为0.5mol/L,c(A):c(B)=3:5,C的平均反应速率是0.1 mol/(L·min)。
求:(1)此时A的浓度及反应开始前容器中A、B的物质的量;
(2)B的平均反应速率;
(3)x的值。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】生活中的一些问题常涉及化学知识,下列叙述正确的是
A. 过多食用糖类物质如淀粉等不会致人发胖
B. 棉花的主要成分是纤维素
C. 淀粉在人体内直接水解生成葡萄糖,供人体组织的所有营养需要
D. 纤维素在人体消化过程中起重要作用,纤维素可以作为人类的营养物质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某矿抽出的废液中含有大量的K+、Cl-、Br-,还有少量的Ca2+、Mg2+、SO![]() 。某研究性学习小组获取这种废液来制取较纯净的氯化钾晶体及液溴(Br2),他们设计了如下流程:
。某研究性学习小组获取这种废液来制取较纯净的氯化钾晶体及液溴(Br2),他们设计了如下流程:
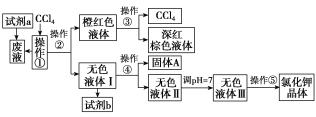
可供试剂a、b的选择试剂:饱和Na2CO3溶液、饱和K2CO3溶液、KOH溶液、BaCl2溶液、Ba(NO3)2溶液、H2O2溶液、稀盐酸。(已知:2Br-+2H++H2O2=Br2+2H2O)
请根据以上流程,回答相关问题:
(1)试剂a应该选用_________________。
(2)操作①、②、③、④、⑤的名称是______________________________(填字母)。
A.萃取、过滤、分液、过滤、蒸发 B.萃取、分液、蒸馏、过滤、蒸发
C.分液、萃取、过滤、过滤、蒸发 D.萃取、分液、分液、过滤、蒸发
(3)除去无色液体Ⅰ中的Ca2+、Mg2+、SO![]() ,选出b所代表的试剂,按滴加顺序依次是______________(填化学式)。
,选出b所代表的试剂,按滴加顺序依次是______________(填化学式)。
(4)调节pH的作用是________________,操作方法是_________________。
(5)操作⑤中用到的瓷质仪器的名称是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与人类生产、生活密切相关,下列说法正确的是 ( )
A.硅酸多孔、吸水能力强,常用作袋装食品的干燥
B.绿色化学的核心是利用化学原理对环境污染进行治理
C.石油的分馏、煤的干馏、石油的裂解都是化学变化
D.为防止中秋月饼等富脂食品氧化变质,常在包装袋中放入生石灰
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学无处不在,运用化学知识判断下列与化学有关的说法正确的是( )
A.地沟油的主要成分是高级脂肪酸甘油酯,可用于制肥皂和加工食用油
B.SO2能漂白纸浆等,故可广泛用于食品的漂白
C.高空臭氧层吸收太阳紫外线,保护地球生物;低空过量臭氧是污染气体,对人体有害
D.为防止富脂食品氧化变质,常在包装袋中放入生石灰
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下的甲烷和一氧化碳的混合气体8.96L,其质量为7.60g,求:
(1)混合气体的平均相对分子质量;
(2)混合气体中甲烷的体积;
(3)混合气体中一氧化碳的质量。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分实验室需要450 mL 1.0 mol·L-1的硫酸溶液,某小组的同学设计如下实验步骤并依此进行配制,请回答相关问题。(已知所用98%浓硫酸的密度为1.84 g/mL)
①计算需98%的浓硫酸的体积;
②在烧杯中将浓硫酸稀释;
③接着将稀释后的硫酸转移到容量瓶中;
④洗涤烧杯和玻璃棒3次,并将洗涤液转移到容量瓶中;
⑤定容;
⑥摇匀。
(1)该实验中选用的定量仪器,除量筒外,还有________________。
(2)该实验应该用(多大规格)_____ ______的量筒(可供选择的量筒规格为10 mL、15 mL、20 mL、50 mL和100 mL),量取___________mL 98%的浓硫酸。
(3)①在配制过程中,如果没有洗涤烧杯和玻璃棒,其他操作都正确,那么所配溶液的实际浓度将_____________(填“偏大、偏小、无影响”)
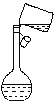
②某同学转移溶液的操作如图所示,该同学操作中的错误是 。
③若用胶头滴管定容时,不小心滴水滴过了刻度线,你认为应该采取的处理方法是: 。
④下列操作中,可能造成所配制溶液的浓度偏高的是 (填选项)。
a.溶解后没有冷却至室温就将液体转移至容量瓶中
b.定容时,俯视刻度线
c.洗涤后的容量瓶中残留少量蒸馏水
d.用量筒量取浓硫酸,读数时仰视刻度线
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com