
| Cu |
| △ |
| Cu |
| △ |
| △ |
| △ |


 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案科目:高中化学 来源: 题型:
A、 向Ⅰ中通入过量CO2,出现白色沉淀,则溶液中一定含有AlO2- |
B、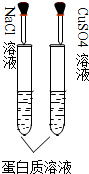 两支试管中蛋白质溶液均会变性 |
C、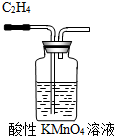 除去C2H4中的SO2 |
D、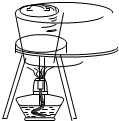 海带灼烧成灰 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
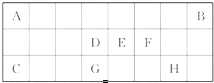 下表是元素周期表中短周期元素的一部分,表中所列字母分别代表一种元素.
下表是元素周期表中短周期元素的一部分,表中所列字母分别代表一种元素.查看答案和解析>>
科目:高中化学 来源: 题型:
| ⅠA | ||||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ② | ③ | ④ | ⑧ | ||||
| 3 | ⑤ | ⑥ | ⑦ | ⑨ | ||||
查看答案和解析>>
科目:高中化学 来源: 题型:
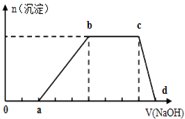 某溶液中可能含有H+、K+、NH4+、Mg2+、Fe3+、Al3+、Cu2+、SO42-、I-、CO32-等离子,当向该溶液中加入某浓度的NaOH溶液时,发现沉淀的物质的量随NaOH溶液的体积变化如图所示,由此可知:
某溶液中可能含有H+、K+、NH4+、Mg2+、Fe3+、Al3+、Cu2+、SO42-、I-、CO32-等离子,当向该溶液中加入某浓度的NaOH溶液时,发现沉淀的物质的量随NaOH溶液的体积变化如图所示,由此可知:查看答案和解析>>
科目:高中化学 来源: 题型:
| A | |||||||||||||||||
| D | E | F | |||||||||||||||
| B | C | G | H | I | J |
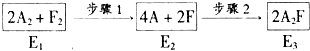
查看答案和解析>>
科目:高中化学 来源: 题型:
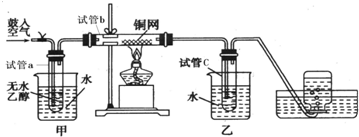
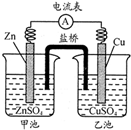 中学教材引入了带盐桥的原电池,该电池即为1806年丹尼尔设计的原电池.如图,下列有关分析正确的是( )
中学教材引入了带盐桥的原电池,该电池即为1806年丹尼尔设计的原电池.如图,下列有关分析正确的是( )| A、负极发生氧化反应:Cu-2e-=Cu2+ |
| B、电池工作时,盐桥逐渐变蓝 |
| C、向乙池中通入H2S后,电池反应停止 |
| D、若将电极Cu改为石墨,电池电流强度发生变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、-332 | B、-118 |
| C、+350 | D、+130 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com