
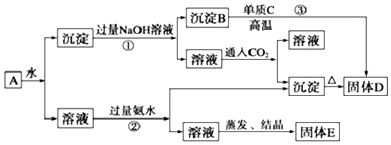
分析 KAl(SO4)2溶于水,Al2O3和Fe2O3均不溶于水,混合物A加水溶解后,溶液中是KAl(SO4)2,沉淀是Al2O3和Fe2O3;向沉淀中加NaOH溶液,Fe2O3不反应,Al2O3可与NaOH溶液反应生成NaAlO2,则B为Fe2O3,向NaAlO2溶液中通入CO2可得Al(OH)3沉淀,Al(OH)3受热分解生成Al2O3,则D为Al2O3,反应③为铝热反应,单质C为Al;向溶液中加过量氨水,溶液与过量氨水反应,Al3+被沉淀,得到氢氧化铝沉淀,溶液中剩余的是K2SO4 和(NH4)2SO4,经过蒸发、结晶,得到E中含K2SO4 和(NH4)2SO4,以此解答该题.
解答 解:KAl(SO4)2溶于水,Al2O3和Fe2O3均不溶于水,混合物A加水溶解后,溶液中是KAl(SO4)2,沉淀是Al2O3和Fe2O3;向沉淀中加NaOH溶液,Fe2O3不反应,Al2O3可与NaOH溶液反应生成NaAlO2,则B为Fe2O3,向NaAlO2溶液中通入CO2可得Al(OH)3沉淀,Al(OH)3受热分解生成Al2O3,则D为Al2O3,反应③为铝热反应,单质C为Al;向溶液中加过量氨水,溶液与过量氨水反应,Al3+被沉淀,得到氢氧化铝沉淀,溶液中剩余的是K2SO4 和(NH4)2SO4,经过蒸发、结晶,得到E中含K2SO4 和(NH4)2SO4,
(1)由以上分析可知固体E中含K2SO4 和(NH4)2SO4,故答案为:K2SO4、(NH4)2SO4;
(2)反应③为铝热反应,方程式为2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3,该反应称为铝热反应,故答案为:2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3;铝热反应;
(3)反应①为Al2O3和氢氧化钠的反应,离子方程式为Al2O3+2OH-═2AlO2-+H2O,故答案为:Al2O3+2OH-═2AlO2-+H2O;
(4)反应②为Al3+和氨水的反应,反应的离子方程式为Al3++3NH3•H2O═Al(OH)3↓+3NH4+,故答案为:Al3++3NH3•H2O═Al(OH)3↓+3NH4+;
(5)实验室配制氯化亚铁溶液时是把氯化亚铁溶解于煮沸过的蒸馏水中,并加入盐酸和铁粉,盐酸可抑制水解,铁粉可防止亚铁离子被氧化;
氯化亚铁溶液中加入NaOH溶液后,发生反应:FeCl2+2NaOH=Fe(OH)2↓+2NaCl,先生成白色沉淀,白色沉淀迅速经灰绿色并转化为红褐色沉淀,反应的化学方程式为:4Fe(OH)2+O2+2H2O=4Fe(OH)3,
故答案为:盐酸;铁粉;FeCl2+2NaOH=Fe(OH)2↓+2NaCl;4Fe(OH)2+O2+2H2O=4Fe(OH)3.
点评 本题考查混合物分离提纯,为高频考点,把握物质的性质、流程中的反应为解答的关键,侧重分析与应用能力的考查,注意元素化合物知识的综合应用,题目难度不大.


 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 将40gNaOH固体溶解于1L水中 | |
| B. | 将22.4L氯化氢气体溶于水配成1L溶液 | |
| C. | 将1L10mol/L浓盐酸与10L水混合 | |
| D. | 10gNaOH固体溶解在水中配成250mL溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N2$→_{放电}^{O_{2}}$NO2$\stackrel{H_{2}O}{→}$HNO3 | |
| B. | MnO2$→_{△}^{浓盐酸}$Cl2$\stackrel{石灰水}{→}$漂白粉 | |
| C. | 黄铁矿$→_{煅烧}^{沸腾炉}$SO2$→_{O_{2}}^{接触室}$SO3$→_{水}^{吸收塔}$稀硫酸 | |
| D. | 铝土矿$→_{过滤}^{NaOH溶液}$NaAlO2溶液$→_{过滤}^{CO_{2}}$Al(OH)3$\stackrel{△}{→}$Al2O3$\stackrel{电解}{→}$Al |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯和苯都能使溴水褪色,褪色的原理相同 | |
| B. | 由甲苯硝化制三硝基甲苯(TNT)和由甲苯氧化制苯甲酸属于同一种反应类型 | |
| C. | 煤油可由石油分馏获得,可用作燃料和保存少量金属钠 | |
| D. | 除去C2H2中的杂质H2S,可依次通过盛有酸性KMnO4溶液、浓硫酸的洗气瓶 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同温同压下,相同体积的物质,它们的物质的量相同 | |
| B. | 常温常压下,等质量的N2与CO所含分子数相同 | |
| C. | 同温同体积下,同质量的H2与O2的压强比约为1:16 | |
| D. | A容器中的H2与B容器中的NH3所含原子总数相等,则两容器的体积比为2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com