
【题目】氨在生产生活中应用广泛。
(1) NH2Cl与水反应生成强氧化性的物质,可作长效缓释消毒剂,工业上可通过反应:NH3(g)+Cl2(g)=NH2Cl(g) + HCl(g)制备氯胺,已知部分化学键的键能如下表所示(假定不同物质中同种化学键的键能一样), 则上述反应的H=__________kJ·mol—1
化学键 | N-H | Cl-Cl | N-Cl | H-Cl |
键能/(kJ/mol) | a | b | c | d |
(2)氨气是重要的化工产品。目前工业合成氨的原理是: N2(g)+3H2(g) ![]() 2NH3(g)。在恒温恒压装置中进行工业合成氨反应,下列说法正确的是__________。
2NH3(g)。在恒温恒压装置中进行工业合成氨反应,下列说法正确的是__________。
a.气体压强不再变化时,表明该反应已达平衡状态
b.气体密度不再变化时,表明该反应已达平衡状态
c.平衡后,压缩容器,会生成更多NH3
d.平衡后,向装置中通入一定量Ar, 平衡不移动
(3)现向三个体积均为5L,温度分别恒定为T1、 T2、T3的恒容密闭容器I、II、 III中,分别充入1 mol N2和3 molH2发生反应: N2(g)+3H2(g) ![]() 2NH3(g) H1=-93 kJ·mol—1,当反应均进行到2min时H2的体积分数如图所示,其中只有一个容器中的反应已经达到平衡状态。
2NH3(g) H1=-93 kJ·mol—1,当反应均进行到2min时H2的体积分数如图所示,其中只有一个容器中的反应已经达到平衡状态。

①2min时三个容器中的反应达到化学平衡状态的是_____容器.(填“I”、“II”或“III”)。
②0~2 min内容器I中用NH3表示的化学反应速率v(NH3)=____。 (保留两位有效数字)
③2 min时容器II中v正______ v逆。 (填“<”、 “>”或“=”)
④当三个容器中的反应均达到平衡状态时,平衡常数最小的是容器______(填容器序号),它的数值为____(保留两位有效数字)。
(4)氨在高温下可将一些固体金属氧化物还原为固态或液态金属单质,本身被氧化为N2。在不同温度下,氨气还原四种金属氧化物达到平衡后,气体中![]() 与温度(T)的关系如图所示。下列说法正确的是______(填字母)。
与温度(T)的关系如图所示。下列说法正确的是______(填字母)。
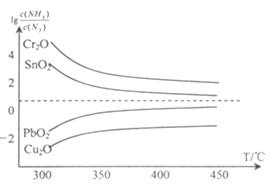
A. NH3还原PbO2的反应△H>0
B.工业冶炼这四种金属时,NH3冶炼金属铬(Cr)的还原效率最低
C.实验室还原出金属铜(Cu)时,325°C 下NH3的利用率比425°C下NH3的利用率更大
D.通过延长反应管的长度来增加金属氧化物和NH3的接触面积,可以减少尾气中NH3的量
【答案】a+b-c-d bc Ⅲ 0.064molL1min 1 > III 2.1 L2mol2 BC
【解析】
(1)反应的焓变等于反应物的键能之和减去生成物的键能之和;
(2)a.在恒温恒压装置中气体压强始终没有变化;
b.反应中,由质量守恒定律可知气体质量不变,该反应是一个气体体积减小的可逆反应,容器的体积会减小,气体密度增大;
c.该反应是一个气体体积减小的可逆反应,平衡后,压缩容器,容器的压强增大,平衡向正反应方向移动;
d.在恒温恒压装置中合成氨反应达到平衡后,向装置中通入一定量Ar,容器的压强减小,平衡向逆反应方向移动;
(3)①若未达平衡,温度越高反应速率越快,相同时间内氢气的含量越低;
②依据题意建立三段式求解可得;
③若未达平衡,温度越高反应速率越快,相同时间内氢气的含量越低,2min时,氢气的含量Ⅲ最大,则II没有达到平衡;
④合成氨反应为放热反应,升高温度,平衡向逆反应方向移动,平衡常数减小,则当三个容器中的反应均达到平衡状态时,平衡常数最小的是容器Ⅲ,依据题意建立三段式求解可得;
(4)![]() 的值越大,说明冶炼金属的还原效率越低,NH3的利用率越大。
的值越大,说明冶炼金属的还原效率越低,NH3的利用率越大。
(1)反应的焓变等于反应物的键能之和减去生成物的键能之和,则反应的H=[3E(N-H)+E(Cl-Cl)]—[2 E(N-H)+E(N-Cl)+E(H-Cl)]=(a+b-c-d)kJ·mol—1,故答案为:a+b-c-d;
(2)a.在恒温恒压装置中气体压强始终没有变化,气体压强不再变化不能表明该反应已达平衡状态,故错误;
b.反应中,由质量守恒定律可知气体质量不变,该反应是一个气体体积减小的可逆反应,容器的体积会减小,气体密度增大,则气体密度不再变化能表明该反应已达平衡状态,故正确;
c.该反应是一个气体体积减小的可逆反应,平衡后,压缩容器,容器的压强增大,平衡向正反应方向移动,NH3的量增大,故正确;
d.在恒温恒压装置中合成氨反应达到平衡后,向装置中通入一定量Ar,容器的压强减小,平衡向逆反应方向移动,故错误;
bc正确,故答案为:bc;
(3)①若未达平衡,温度越高反应速率越快,相同时间内氢气的含量越低,2min时,氢气的含量Ⅲ最大,则Ⅲ到达平衡,故答案为:Ⅲ到达平衡;
②设0~2 min内容器I中氨气的转化率为x,由题意建立如下三段式:
由氢气百分含量为40%可得![]() ×100%=40%,解得x=
×100%=40%,解得x=![]() ,则化学反应速率v(NH3)=
,则化学反应速率v(NH3)= ![]() ≈0.064 molL1min 1,故答案为:0.064 molL1min 1;
≈0.064 molL1min 1,故答案为:0.064 molL1min 1;
③若未达平衡,温度越高反应速率越快,相同时间内氢气的含量越低,2min时,氢气的含量Ⅲ最大,则II没有达到平衡,则v正>v逆,故答案为:>;
④合成氨反应为放热反应,升高温度,平衡向逆反应方向移动,平衡常数减小,则当三个容器中的反应均达到平衡状态时,平衡常数最小的是容器Ⅲ,设0~2 min内容器中氨气的转化率为x,由题意建立如下三段式:

由氢气百分含量为60%可得![]() ×100%=60%,解得x=
×100%=60%,解得x=![]() ,则平衡常数K=
,则平衡常数K=![]() ≈2.1L2mol2,故答案为:2.1L2mol2;
≈2.1L2mol2,故答案为:2.1L2mol2;
(4)A.由图可知,NH3还原PbO2时,升高温度,![]() 增大,说明平衡向逆反应方向移动,NH3还原PbO2的反应为放热反应,△H<0,故错误;
增大,说明平衡向逆反应方向移动,NH3还原PbO2的反应为放热反应,△H<0,故错误;
B.相同温度时,![]() 的值越大,说明冶炼金属的还原效率越低,由图可知,相同温度时,NH3冶炼金属铬(Cr)的
的值越大,说明冶炼金属的还原效率越低,由图可知,相同温度时,NH3冶炼金属铬(Cr)的![]() 最大,则还原效率最低,故正确;
最大,则还原效率最低,故正确;
C.![]() 的值越大,说明NH3的利用率越大,由图可知,还原出金属铜(Cu)时,温度升高,
的值越大,说明NH3的利用率越大,由图可知,还原出金属铜(Cu)时,温度升高,![]() 增大,则325°C 下NH3的利用率比425°C下NH3的利用率更大,故正确;
增大,则325°C 下NH3的利用率比425°C下NH3的利用率更大,故正确;
D.、通过延长反应管的长度不能增加金属氧化物的表面积,不能增大金属氧化物和NH3的接触面积,故D错误;
BC正确,故答案为:BC。


科目:高中化学 来源: 题型:
【题目】下列说法中,正确的是( )
A.1molH2SO4与1 molBa(OH)2反应生成H2O时放出的热叫做中和热
B.△H>0kJmol-1表示放热反应,![]() <0kJmol-1表示吸热反应
<0kJmol-1表示吸热反应
C.热化学方程式中的化学计量数表示物质的量,可以是分数
D.1molH2与0.5molO2反应放出的热就是H2的燃烧热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用图装置(气密性好)研究钠与氯气的反应。

实验步骤:
①将一定量浓盐酸滴在KMnO4粉末上,立即产生黄绿色气体。
②待黄绿色气体均匀充满集气瓶时,关闭止水夹。
③再向钠粒上滴2滴水,片刻后钠燃烧,产生白烟,白色固体附着在集气瓶内壁上。
(1)步骤①,黄绿色气体是氯气,则KMnO4的作用是__________(填“氧化剂”或“还原剂”)。
(2)步骤③,引起钠燃烧的原因是____________。
(3)生成白色固体的化学方程式是______________。
(4)结合离子方程式说明NaOH溶液的作用是_______________。
(5)实验结束后,甲同学在安全、环保的理念指导下,仅用上图装置就完成了集气瓶内残余氯气的处理,其操作是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有A、B、C、D、E五种有机物,它们有如下相互转化关系:

已知:A是相对分子质量为28的烃,E属于高分子化合物。请完成下列各题:
(1)物质A的名称是______________,物质D的结构简式为____________________。
(2)写出反应①的化学方程式:_______,该反应属于_____________反应。
(3)写出反应②的化学方程式:______________,该反应属于_____________反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁电池是一种新型可充电电池,与普通高能电池相比,该电池长时间保持稳定的放电电压。高铁电池的总反应为3Zn+2K2FeO4+8H2O![]() 3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述不正确的是
3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述不正确的是
A.放电时负极反应为:Zn+2OH--2e-=Zn(OH)2
B.充电时阳极反应为:Fe(OH)3+5OH--3e-=FeO42-+4H2O
C.放电时每转移3mol电子,正极有1mol K2FeO4被氧化
D.放电时正极附近溶液的碱性增强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】银制器皿表面日久因生成Ag2S而变黑,可进行如下处理:将表面发黑的银器浸入盛有食盐水的铝质容器中(如图),一段时间后黑色褪去。有关说法正确的是( )

A.该处理过程中电能转化为化学能
B.银器为正极,Ag2S还原为单质银
C.Ag2S溶解于食盐水生成了AgCl
D.铝质容器质量增加
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含铁化合物在生活生产中应用广泛。如高铁酸盐(FeO42-)被科学家们公认为绿色消毒剂,在强碱性溶液中比较稳定;聚合硫酸铁则是一种高效絮凝剂。
(1)KClO与Fe(NO3)3饱和溶液反应可制备K2FeO4,两种溶液的混合方式为____。
A.在搅拌下,将Fe(NO3)3饱和溶液缓慢滴加到KClO饱和溶液中
B.在搅拌下,将KClO饱和溶液缓慢滴加到Fe(NO3)3饱和溶液中
C.在搅拌下,将KClO饱和溶液和Fe(NO3)3饱和溶液一起加入
反应的离子方程式为______________________________。
(2)高铁酸盐有极强的氧化性,能迅速有效地去除淤泥中的臭味物质,自身被还原成新生态的Fe(OH)3。已知Ksp[Fe(OH)3]=1.0×10-38。若要使溶液中Fe3+沉淀完全(使其浓度小于10-5 mol·L-1),需调节溶液的pH>____。
(3)聚合硫酸铁[Fex(OH)y(SO4)z]的组成可通过下列实验测定:
①称取一定质量的聚合硫酸铁配成100.00 mL溶液A;
②准确量取20.00 mL溶液A,加入盐酸酸化的BaCl2溶液至沉淀完全,过滤、洗涤、干燥至恒重,得到白色固体11.65g;
③准确量取20.00 mL溶液A,加入足量铜粉,充分反应后过滤、洗涤,将滤液和洗液合并配成250.00 mL溶液B;
④准确量取25.00 mL溶液B,用0.100 0 mol·L-1酸性KMnO4溶液滴定至终点,消耗KMnO4溶液8.00 mL。
通过计算确定该聚合硫酸铁的化学式(写出计算过程)______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组的同学用下图所示装置研究有关电化学的问题。当闭合该装置的电键时,观察到检流计的指针发生了偏转。

请回答下列问题:
(1)甲池为________(填“原电池”、“电解池”或“电镀池”),通入CH3OH一极的电极反应式为_____________________________________________________________;
(2)乙池中A(石墨)电极的名称为________(填“正极”、“负极”、“阴极”或“阳极”),总反应式为_________________________________________________________;
(3)当乙池中B极质量增加5.40 g时,甲池中理论上消耗O2的体积为________ mL(标准状况),丙池中________极析出________ g铜;
(4)若丙中电极不变,将其溶液换成NaCl溶液,电键闭合一段时间后,甲中溶液的pH将________(填“增大”、“减小”或“不变”);丙中溶液的pH将________(填“增大”、“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室以绿矾(FeSO4·7H2O)制备补血剂甘氨酸亚铁[(NH2CH2COO)2Fe] 有关物质性质如下:
甘氨酸(NH2CH2COOH) | 柠檬酸 | 甘氨酸亚铁 |
易溶于水,微溶于乙醇,两性化合物 | 易溶于水和乙醇,有强酸性和还原性 | 易溶于水,难溶于乙醇 |
实验过程:
Ⅰ.配制含0.10mol FeSO4的绿矾溶液。
Ⅱ.制备FeCO3:向配制好的绿矾溶液中,缓慢加入200mL 1.1mol·L-1NH4HCO3溶液,边加边搅拌,反应结束后过滤并洗涤沉淀。
Ⅲ.制备(NH2CH2COO)2Fe:实验装置如下图(夹持和加热仪器已省略),将实验Ⅱ得到的沉淀和含0.20 mol甘氨酸的水溶液混合后加入C中,然后利用A中的反应将C中空气排净,接着滴入柠檬酸溶液并加热。反应结束后过滤,滤液经蒸发结晶、过滤、洗涤、干燥得到产品。
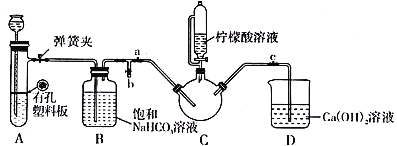
回答下列问题:
(1)实验I中:实验室配制绿矾溶液时,为防止FeSO4被氧化变质,应加入的试剂为_______(写化学式)。再滴加少量稀硫酸的作用是__________________________。
(2)实验II中:生成沉淀的离子方程式为__________________________。
(3)实验Ⅲ中:①C中盛柠檬酸溶液的仪器名称为___________________。
②装置A中所盛放的药品是___________________。(填序号)
A.Na2CO3和稀H2SO4 B.CaCO3和稀H2SO4 C.CaCO3和稀盐酸
③确认C中空气排尽的实验现象是____________________。
④加入柠檬酸溶液一方面可调节溶液的pH促进FeCO3溶解,另一个作用是________________。
⑤洗涤实验Ⅲ中得到的沉淀,所选用的最佳洗涤试剂是___________________。(填序号)
A.热水 B.乙醇溶液 C.柠檬酸溶液
⑥若产品的质量为17.34g,则产率为________%。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com