
下列热化学方程式书写正确的是(ΔH的绝对值均正确)( )
A.C2H5OH(l)+3O2(g)====2CO2(g)+3H2O(g);ΔH=-1 367.0 kJ/mol(燃烧热)
B.NaOH(aq)+HCl(aq)====NaCl(aq)+H2O(l);ΔH=+57.3 kJ/mol(中和热)
C.S(s)+O2(g)====SO2(g);ΔH=-296.8 kJ/mol(反应热)
D.2NO2====O2+2NO;ΔH=+116.2 kJ/mol(反应热)
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
下列依据相关实验得出的结论正确的是
A.向某溶液中加入稀盐酸,产生的气体能使澄清石灰水变浑浊,该溶液一定是碳酸盐溶液
B.用铂丝蘸取少量某溶液进行焰色反应,火焰呈黄色,该溶液一定是钠盐溶液
C.将某气体通入溴水中,溴水颜色褪去,该气体一定是乙烯
D.向某溶液中滴加KSCN 溶液,溶液不变色,滴加氯水后溶液显红色,该溶液中一定含Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
灰锡(以粉末状存在)和白锡是锡的两种同素异形体。已知:
①Sn(s、白)+2HCl(aq)=SnCl2(aq)+H2(g) △H1
②Sn(s、灰)+2HCl(aq)=SnCl2(aq)+H2(g) △H2
③Sn(s、灰) Sn(s、白) △H3=+2.1kJ/mol
Sn(s、白) △H3=+2.1kJ/mol
下列说法正确的是
A △H1>△H2
B 锡在常温下以灰锡状态存在
C 灰锡转化为白锡的反应是放热反应
D 锡制器皿长期处于低于13.2℃的环境中,会自行毁坏
查看答案和解析>>
科目:高中化学 来源: 题型:
碳酸钠是造纸、玻璃、纺织、制革等行业的重要原料。工业碳酸钠(纯度约98%)中含有Ca2+、Mg2+、Fe3+、Cl-和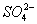 等杂质,提纯工艺路线如下:
等杂质,提纯工艺路线如下:
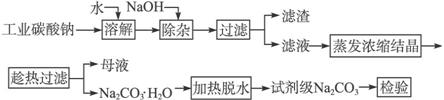
已知碳酸钠的溶解度(S)随温度变化的曲线如下图所示:

回答下列问题:
(1)滤渣的主要成分为________________。
(2)“趁热过滤”的原因是________________________________________。
(3)若在实验室进行“趁热过滤”,可采取的措施是_______________________(写出1种)。
(4)若“母液”循环使用,可能出现的问题及其原因是_____________________________。
(5)已知:Na2CO3·10H2O(s) Na2CO3(s)+10H2O(g) ΔH1=+532.36 kJ·mol-1
Na2CO3(s)+10H2O(g) ΔH1=+532.36 kJ·mol-1
Na2CO3·10H2O(s) Na2CO3·H2O(s)+9H2O(g) ΔH2=+473.63 kJ·mol-1
Na2CO3·H2O(s)+9H2O(g) ΔH2=+473.63 kJ·mol-1
写出Na2CO3·H2O脱水反应的热化学方程式______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知氯气、溴蒸气分别跟氢气反应的热化学方程式如下(Q1、Q2均为正值):
H2(g)+Cl2(g)  2HCl(g)+Q1
2HCl(g)+Q1
H2(g)+Br2(g)  2HBr(g)+Q2
2HBr(g)+Q2
有关上述反应的叙述正确的是( )
A.Q1>Q2
B.生成物总能量均高于反应物总能量
C.生成1 mol HCl气体时放出Q1热量
D.1 mol HBr(g)具有的能量大于1 mol HBr(l)具有的能量
查看答案和解析>>
科目:高中化学 来源: 题型:
右图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容。据此下列说法正确的是

A.该硫酸的物质的量浓度为9.2 mol·L-1
B.1 mol 铁加入到足量的该硫酸中,可产生2 g H2
C.该硫酸与等质量的水混合所得溶液的物质的量浓度大于9.2 mol·L-1
D.配制200 mL,4.6 mol·L-1的硫酸溶液需取该硫酸50 mL
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式书写正确的是
A.FeCl2溶液中能入氯气:Fe2++Cl2 ===== Fe3++2Cl-
B.澄清石灰水与少量小苏打溶液混合:Ca2++OH-+HCO3-===== Ca CO3↓+H2O
C.FeS固体放入稀硝酸溶液中:FeS+2H+===== Fe2++H2S↑
D.碳酸氢镁和足量的氢氧化钙溶液反应:Ca2++OH-+HCO3-===== Ca CO3↓+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
除去下列括号内杂质的试剂或方法错误的是
A.HNO3溶液(H2SO4),适量BaCl2溶液,过滤
B.CO2(SO2),酸性KMnO4溶液、浓硫酸,洗气
C.KNO3晶体(NaCl),蒸馏水,结晶
D.C2H5OH(CH3COOH),加足量CaO,蒸馏
查看答案和解析>>
科目:高中化学 来源: 题型:
某研究性学习小组借助A~D的仪器装置完成有关实验。

[实验一] 收集NO气体。
(1)用装置A收集NO气体,正确的操作是_____________(填序号)。
a.从①口进气,用排水法集气 b.从①口进气,用排气法集气
c.从②口进气,用排水法集气 d.从②口进气,用排气法集气
[实验二]为了探究镀锌薄铁板上锌的质量分数w(Zn)和镀层厚度,查询得知锌易溶于强碱:Zn+2NaOH====Na2ZnO2+H2↑。据此,截取面积为S的双面镀锌薄铁板试样,剪碎、称得质量为m1 g。用固体烧碱和水作试剂,拟出下列实验方案并进行相关实验。
方案甲:通过测量试样与碱反应生成的氢气体积来实现探究目标。
(2)选用B和_____________(填仪器标号)两个装置进行实验。
(3)测得充分反应后生成氢气的体积为V L(标准状况),w(Zn)=___________。
(4)计算镀层厚度,还需检索的一个物理量是___________。
(5)若装置B中的恒压分液漏斗改为普通分液漏斗,测量结果将_________(填“偏大”“偏小”或“无影响”)。
方案乙:通过称量试样与碱反应前后的质量实现探究目标。选用仪器C做实验,试样经充分反应,滤出不溶物、洗涤、烘干,称得其质量为m2 g。
(6)w(Zn)=___________。
方案丙:通过称量试样与碱反应前后仪器、试样和试剂的总质量(其差值即为H2的质量)实现探究目标。实验同样使用仪器C。
(7)从实验误差角度分析,方案丙___________方案乙(填“优于”“劣于”或“等同于”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com