
下列离子方程式书写正确的是
| A.碳酸钙与盐酸反应 CO32-+2H+=CO2↑+H2O |
| B.硫酸和氯化钡溶液反应 Ba2++SO42-=BaSO4↓ |
| C.氢氧化钠和少量氢硫酸反应 OH-+H2S=S2-+H2O |
| D.铁钉放入硫酸铜溶液中 Fe+3Cu2+=2Fe3++3Cu |
 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案科目:高中化学 来源: 题型:单选题
下列说法及对应的离子方程式均正确的是
A.铁溶于稀HNO3,溶液变黄色:3Fe + 8H+ + 2NO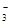 = 3Fe2+ + 2NO↑ + 4H2O = 3Fe2+ + 2NO↑ + 4H2O |
B.用惰性电极电解AlCl3溶液:Al3+ + 3Cl- + 3H2O  Al(OH)3↓ + 3/2H2↑ + 3/2Cl2↑ Al(OH)3↓ + 3/2H2↑ + 3/2Cl2↑ |
C.用酚酞作指示剂,在Na2CO3溶液中滴入乙酸溶液:CO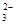 + 2CH3COOH = 2CH3COO- + H2O + CO2↑ + 2CH3COOH = 2CH3COO- + H2O + CO2↑ |
D.在K2Cr2O7溶液中滴入NaOH溶液,溶液变为橙色:Cr2O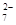 (橙)+ H2O (橙)+ H2O  2CrO 2CrO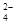 (黄)+2H+ (黄)+2H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
某强碱性溶液中,能大量共存的离子组是
| A.K+、Na+、AlO2-、SO42- | B.K+、Na+、ClO-、S2- |
| C.Na+、K+、SO42-、HCO3- | D.Ca2+、K+、NO3-、I- |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
用可溶性钡盐检验SO42-离子的存在时,先在待测溶液中加入盐酸,其作用是 ( )
| A.形成较多的白色沉淀 |
| B.形成的沉淀纯度更高 |
| C.排除SO42- 以外的其它阴离子及Ag+的干扰 |
| D.排除Ba2+ 以外的其它阳离子的干扰 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列离子在指定溶液中一定能大量共存的是
| A.碱性溶液中:Na+、K+、SO32-、S2- |
| B.无色溶液中:Na+、Fe3+、Cl-、SO42- |
| C.无色溶液中:Na+、K+、HCO3-、AlO2- |
| D.酸性溶液中:Na+、K+、NO3-、ClO- |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列各组离子,能在强酸溶液中大量共存。并且溶液呈无色的是
| A.Mg2+、Na+、SO42-、Cl- | B.K+、Na+、NO3-、MnO4- |
| C.Na+、Ca2+、OH-、HCO3- | D.NH4+、Cu2+、NO3-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
现有E、F、G、M、N五种可溶的强电解质,它们在水中电离产生下列离子(各种离子不重复)。
| 阳离子 | H+、Na+、Al3+、Ag+、Ba2+ |
| 阴离子 | OH-、Cl-、CO32-、NO3-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列离子方程式表达正确的是
| A.氢氧化铁溶于氢碘酸:Fe(OH)3+3H+=Fe3++3H2O |
B.小苏打溶液呈碱性的原因:HCO3-+H2O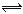 H3O++CO32- H3O++CO32- |
| C.溴化亚铁溶液中通入足量氯气:2Fe2++ 4Br-+ 3Cl2 = 2Fe3++2 Br2 + 6Cl- |
| D.向硫酸铝铵[NH4Al(SO4)2]溶液中滴加少量Ba(OH)2溶液:NH4++Al3++2SO42-+2Ba2++5OH-=AlO2-+2BaSO4↓+NH3·H2O+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列离子反应方程式正确的是
A.铜粉与98.3%的硫酸加热下反应:Cu + 4H+ + SO42― Cu2++ SO2↑+ 2H2O Cu2++ SO2↑+ 2H2O |
B.电解饱和食盐水:2Cl- +2H+ H2↑+C12↑ H2↑+C12↑ |
| C.向氯化铝溶液中加入过量氨水:Al3++ 4NH3·H2O=[Al(OH)4]-+ 4NH4+ |
| D.硫酸亚铁溶液中加入用硫酸酸化的过氧化氢溶液:2Fe2++2H++H2O2=2Fe3++2H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com