
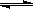 Y+Z,其化学反应速率随时间变化的图像如图所示,其中t1时刻达到平衡,t2时刻缩小容器体积,t3时刻重新达到平衡,下列有关说法不正确的是( )
Y+Z,其化学反应速率随时间变化的图像如图所示,其中t1时刻达到平衡,t2时刻缩小容器体积,t3时刻重新达到平衡,下列有关说法不正确的是( )
| A.X在该条件下一定不为气体 |
| B.Y和Z在该条件下至少有一种为气体 |
| C.t1时刻达到平衡时和t3时刻平衡时,气态物质的浓度相同 |
| D.由t1~t3,平衡并未发生移动。 |
 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案科目:高中化学 来源:不详 题型:问答题
 C6H5CH=CH2(g)+H2 (g) ?△H=+125kJ·mol-1
C6H5CH=CH2(g)+H2 (g) ?△H=+125kJ·mol-1
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
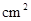 ,容积为2 L的球形容器,使压强为P,然后将整个容器用加热器加热到t℃时,发生如下反应:
,容积为2 L的球形容器,使压强为P,然后将整个容器用加热器加热到t℃时,发生如下反应: 2C(g);?H=-180 kJ·
2C(g);?H=-180 kJ·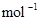
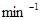 ·
·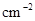 ,为了维持恒温t℃,平均每分钟需用加热器提供________kJ的热量;
,为了维持恒温t℃,平均每分钟需用加热器提供________kJ的热量;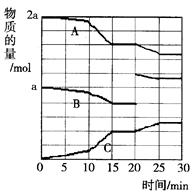
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 CH3OH(g)+H2O(g) +49.0 kJ。反应在2分钟时达到了平衡。
CH3OH(g)+H2O(g) +49.0 kJ。反应在2分钟时达到了平衡。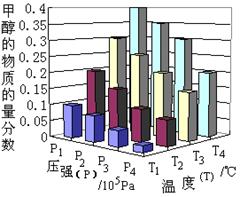
| A.P3>P2T3>T2 | B.P2>P4T4>T2 |
| C.P1>P3T1>T3 | D.P1>P4T2>T3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 CO + H2O,
CO + H2O, 2Z(g);△H<0。右图是容器中X、Z的物质的量浓度随时间变化的曲线。
2Z(g);△H<0。右图是容器中X、Z的物质的量浓度随时间变化的曲线。
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 H+ + In—(aq)
H+ + In—(aq)| A.稀硫酸 | B.氯化铝溶液 | C.稀氨水 | D.饱和食盐水 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 CO2(g)十NO(g)反应过程中能量示意图。一定条件下,在固定容积的密闭容器中该反应达到平衡状态。当改变其中一个条件X,Y随X增大的变化关系曲线如图Ⅱ。
CO2(g)十NO(g)反应过程中能量示意图。一定条件下,在固定容积的密闭容器中该反应达到平衡状态。当改变其中一个条件X,Y随X增大的变化关系曲线如图Ⅱ。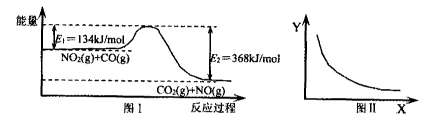
| A.该反应的焓变△H=234 kJ·mol-1 |
| B.若X表示CO的起始浓度,则Y表示的可能是NO2的转化率 |
| C.若X表示温度,则Y表示的可能是CO2的物质的量浓度 |
| D.若X表示反应时间,则Y表示的可能是混合气体的密度 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 H++A-,回答下列问题:
H++A-,回答下列问题:查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
 CO2(g)+H2(g) K=1.0,则CO的转化率为________
CO2(g)+H2(g) K=1.0,则CO的转化率为________ 查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com