
 .
.分析 A、B、D、R、Q五种短周期主族元素,其原子序数依次增大,其中A原子核内无中子,则A为H元素;D元素的原子最外层电子数是次外层电子数的三倍,原子只能有2个电子层,最外层电子数为6,故D为O元素;D与Q同主族,则Q为S元素;B与D同周期,B元素的最高正价和最低负价代数和为2,则B为N元素;R与Q同周期,A与R同主族,则R为Na,据此解答.
解答 解:A、B、D、R、Q五种短周期主族元素,其原子序数依次增大,其中A原子核内无中子,则A为H元素;D元素的原子最外层电子数是次外层电子数的三倍,原子只能有2个电子层,最外层电子数为6,故D为O元素;D与Q同主族,则Q为S元素;B与D同周期,B元素的最高正价和最低负价代数和为2,则B为N元素;R与Q同周期,A与R同主族,则R为Na.
(1)Q为S元素,位于元素周期表中第三周期VIA族,故答案为:三、VIA;
(2)电子层结构相同,核电荷数越大离子半径越小,电子层越多离子半径越大,故离子半径:S2->O2->Na+,故答案为:S2->O2->Na+;
(3)由H、N两种元素以原子个数比为5:1形成的离子化合物X为NH4H,电子式为 ,故答案为:
,故答案为: ;
;
(4)由H、N元素形成的N2H4可以与O2、KOH溶液形成原电池,负极发生氧化反应,N2H4在负极失去电子,碱性条件下生成氮气与水,负极电极反应式为:N2H4+4OH--4e-=N2+4H2O,
故答案为:N2H4+4OH--4e-=N2+4H2O;
(5)H2SO3的Ka1=1.2×10-2、Ka2=6.3×10-8,HSO3-的水解平衡常数为$\frac{1{0}^{-14}}{1.2×1{0}^{-2}}$=8.3×10-13,则NaHSO3溶液中HSO3-的电离程度大于其水解程度,溶液呈酸性,且氢离子源于水的电离、亚硫酸氢根电离,溶液中离子浓度:c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-),
室温下,向NaHSO3溶液中加入一定量的NaOH,使溶液中c(HSO3-)=c(SO32-),由Ka2=$\frac{(S{{O}_{3}}^{2-})×c({H}^{+})}{c(HS{{O}_{3}}^{-})}$=6.3×10-8,则溶液中c(H+)=6.3×10-8<10-7,溶液呈碱性,
故答案为:c(Na2+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-);碱性;
(6)Fe2O3、Fe3O4、Cu的混合物中加入硫酸溶液中,固体恰好完全溶解,所得溶液中不含Fe3+,溶液中溶质为CuSO4、FeSO4,硫酸中H元素与混合物中O元素结合守恒水,由水的分子式H2O可知,故n(O)=n(H2SO4)=0.14L×0.5mol/L=0.07mol,若用过量的CO在高温下还原相同质量的原混合物,固体减少的质量为氧化物中氧元素的质量,所以固体减少的质量为0.07mol×16g/mol=1.12g,
故答案为:1.12.
点评 本题考查结构性质位置关系应用,推断元素是解题关键,(5)中离子浓度大小判断、溶液酸碱性判断需要利用平衡常数进行计算,(6)中注意利用守恒法计算解答,综合考查学生分析能力、逻辑推理能力及对知识的迁移运用,需要学生具备扎实的基础,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 利用布朗运动可区别溶液和胶体 | |
| B. | 溶液中通过一束光线时没有明显现象,胶体中通过一束光线时出现明显的光路 | |
| C. | 胶体微粒带电荷,溶液中溶质微粒不带电荷 | |
| D. | 制备Fe(OH)3胶体的方法是:将饱和FeCl3溶液通入热的NaOH溶液中并持续煮沸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
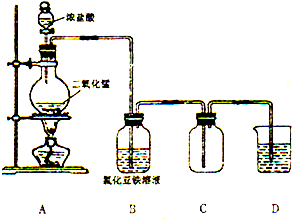 某化学研究型学习小组利用以下装置制取并探究氯气的性质.【装置A中发生反应的化学方程式:MnO2+4HCl(浓)═MnCl2+Cl2↑+2H2O】
某化学研究型学习小组利用以下装置制取并探究氯气的性质.【装置A中发生反应的化学方程式:MnO2+4HCl(浓)═MnCl2+Cl2↑+2H2O】查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 物质的量浓度相等的①NH4C1、②(NH4)2S04、③NH4HS04溶液中,c(NH4+)的大小顺序:②>③>① | |
| B. | 0.2 mol•L-1CH3COOH溶液和0.2 mol•L-1CH3COONa溶液等体积混合:c(CH3COO-)+c(OH-)-c(H+)=0.1 mol•L-1 | |
| C. | pH=2的H2SO3溶液与pH=12的NaOH溶液等体积混合:c(HSO3-)>c(Na+)>c(H+)>c(OH-) | |
| D. | 0.1 mol•L-1NaHCO3溶液中:c(Na+)>c(HCO3-)>c(OH-)>c(CO32-)>c(H2CO3) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸氢钠可用作食品添加剂 | B. | 过氧化钠可用作潜水艇供氧剂 | ||
| C. | 铝制容器可以贮运稀硝酸 | D. | 氧化铁可用作外墙涂料 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
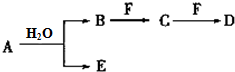 A、B、C、D、E、F为中学化学中的常见物质,且物质A由1~2种短周期元素组成,在一定条件下有如图转化关系,请完成下列问题:
A、B、C、D、E、F为中学化学中的常见物质,且物质A由1~2种短周期元素组成,在一定条件下有如图转化关系,请完成下列问题: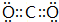 ;D中所含化学键的类型离子键和共价键.
;D中所含化学键的类型离子键和共价键.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稀硫酸、NaCl溶液是实验室常见的强电解质 | |
| B. | 二氧化氮经加压凝成无色液体为物理变化 | |
| C. | Na2O•SiO2是一种简单的硅酸盐,可溶于水 | |
| D. | 溴水滴入植物油中振荡褪色,说明溴被植物油从溴水中萃取出来 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com