

| ||
| ||


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、①②③④ | B、④①③② |
| C、③④②① | D、④③①② |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、溶液中c(Ca2+)增大 |
| B、溶液中溶质的质量分数增大 |
| C、溶液的pH增大 |
| D、溶液中Ca2+离子数目减少 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、为处理锅炉水垢中的CaSO4,可先用饱和Na2CO3溶液浸泡,再加入盐酸溶解 |
| B、实验室制氢气,为了加快反应速率,可向稀H2SO4中滴加少量Cu(NO3)2溶液 |
| C、N2(g)+3H2(g)?2NH3(g)△H<0,其他条件不变升高温度,平衡时氢气转化率增大 |
| D、吸热反应“TiO2(s)+2Cl2(g)═TiCl4(g)+O2(g)”在一定条件下可自发进行,则该反应的△S<0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 现有三个反应:
现有三个反应:| T/℃ | 700 | 800 |
| K1 | 2.38 | 2.56 |
| K2 | 0.80 |
| 反应时间/min | 0 | 2 | 4 | 6 |
| n(CO)/mol | 1.20 | 0.90 | 0.80 | |
| n(H2O)/mol | 0.60 | 0.20 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 利用如图所示装置收集以下8种气体(图中试管的位置不得变化):
利用如图所示装置收集以下8种气体(图中试管的位置不得变化):查看答案和解析>>
科目:高中化学 来源: 题型:
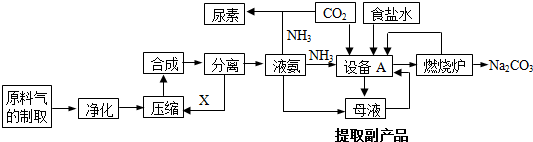

查看答案和解析>>
科目:高中化学 来源: 题型:
 现需配制0.1mol/LNaOH溶液480mL,如图是某同学转移溶液的示意图.
现需配制0.1mol/LNaOH溶液480mL,如图是某同学转移溶液的示意图.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com