
| A.131I、132I、134Cs、137Cs是四种不同的核素 | B.食用碘盐不能防辐射 |
| C.碘片的主要成分是I2 | D.核能仍然是重要能源之一 |
科目:高中化学 来源:不详 题型:实验题
| | 水 | 四氯化碳 |
| 溴 | 黄→棕 | 橙→橙红 |
| 碘 | 深黄→褐 | 紫→深紫 |
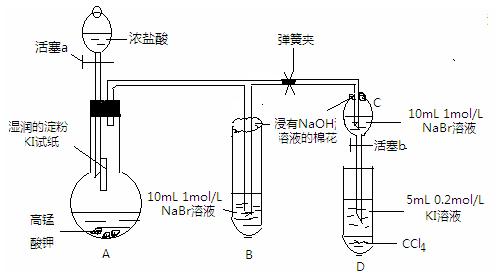
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.晶体熔点由低到高:CF4<CCl4<CBr4<CI4 |
| B.硬度由大到小:金刚石>碳化硅>晶体硅 |
| C.热稳定性:HI>HBr>HCl>HF |
| D.晶格能由大到小: NaF> NaCl> NaBr>NaI |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.硫酸盐的化学式为R2SO4,它易溶于水 |
| B.单质与水剧烈反应甚至发生爆炸 |
| C.R的最高价氧化物对应的水化物的碱性强于氢氧化钠 |
| D.在同族的单质中R的单质熔点最高 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 粒子代码 | X | Y | Z |
| 原子核数 | 单核 | 两核 | 四核 |
| 粒子的电荷数 | 一个单位正电荷 | 一个单位负电荷 | 0 |


查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
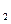 B中溶解性由大到小的顺序为 (填化学式),其原因是 。
B中溶解性由大到小的顺序为 (填化学式),其原因是 。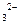 中的B的杂化类型为 ,空间结构为 ,与BD
中的B的杂化类型为 ,空间结构为 ,与BD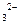 互为等电子体且含C、D两元素的微粒的化学式为 。
互为等电子体且含C、D两元素的微粒的化学式为 。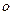 键与
键与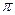 键的个数比为 ,该分子的VSERR模型 。
键的个数比为 ,该分子的VSERR模型 。查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com